В наш центр по телемедицинской заявке пришел запрос на консультацию пациентки с входящим диагнозом: «гигантоклеточная опухоль верхней и нижней челюсти, хирургическое лечение 2000г. По поводу рецидивов хирургическое лечение в 2001, 2007, 2015гг. Прогрессирование, метастазы в грудину, Th6, Th7, L2 позвонки, правую бедренную кость. Таргетная терапия Деносумаб (9 курсов с 09.07.2020). Стабилизация»… Такая формулировка нам показалось очень подозрительной, поскольку множественная ГКО встречается крайне редко, а поражение лицевых костей еще реже. Тем более дебют заболевания, соответственно анамнезу, был в 16л.
В 2000г (в 16 лет) пациентке по поводу остеобластокластомы верхней и нижней челюсти было выполнено хирургическое лечение в челюстно-лицевой хирургии. Рецидивы и соответствующее хирургическое лечение в 2001, 2007, 2015гг. Появление дискомфорта в области грудины заметила около весной-летом 2020г, в то время когда пациентка проходила плановое обследование и подготовку к запланированной реконструктивной операции на нижней челюсти. Тогда то и было выявлено множественное поражение костей скелета: деструктивные очаговые изменения грудины, Тh 6, Th7, L2 позвонках, головке правой бедренной кости (см.рис. 1,2,3).
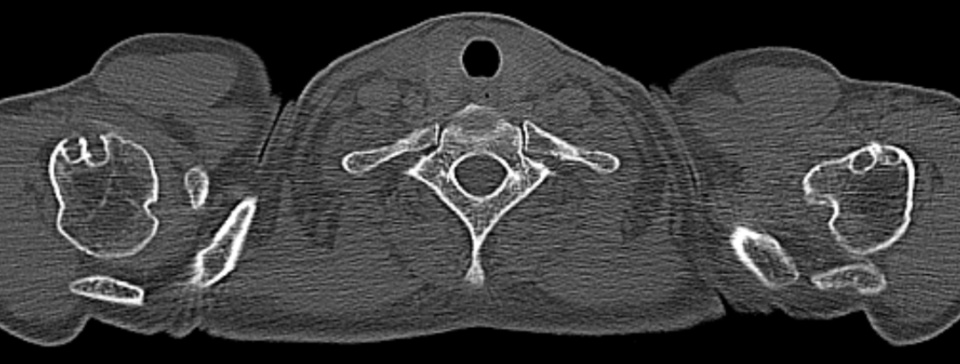
Рис.1
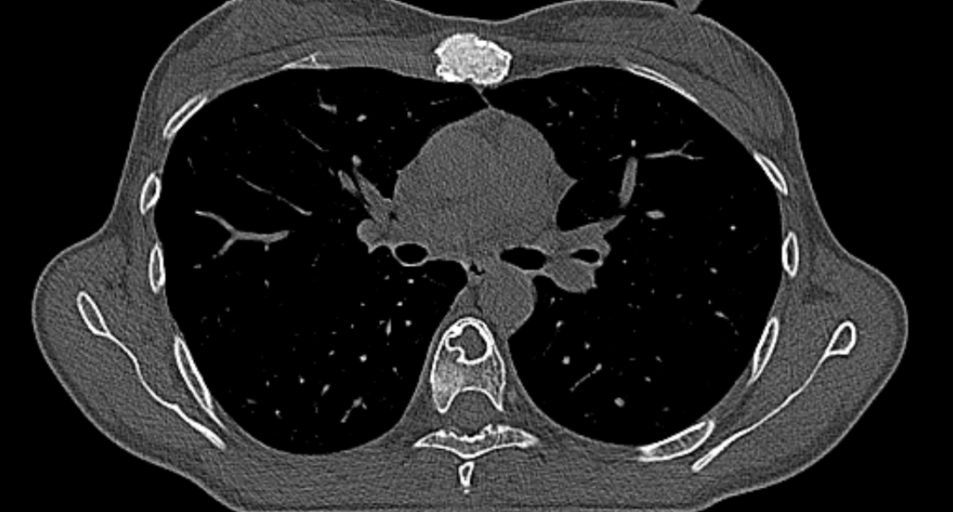
Рис.2
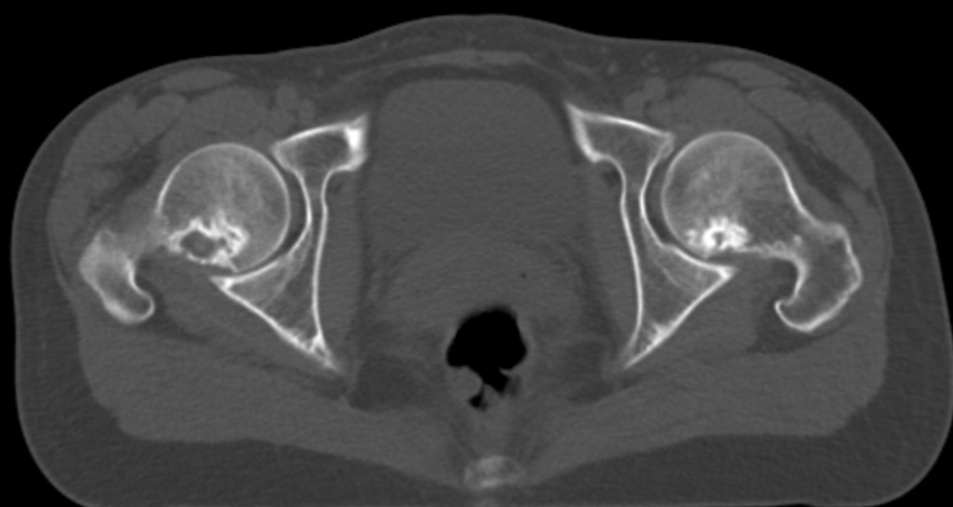
Рис.3
06.05.2020 была выполнена трепан-биопсия опухоли грудины. По данным ИГХ исследования гистологическое строение опухоли грудины и иммунофенотип опухолевых клеток наиболее соответствует гигантоклеточной опухоли кости. По месту жительства было рекомендовано и начато проведение таргетной терапии деносумабом - 120 мг - в 1,8,15 и 28 дне, далее раз в 28 дней с контрольным обследованием в поликлинике НМИЦ после 6 введений. С 09.07.2020 по 28.12.2020 проводилась таргетная терапия деносумабом по данной схеме и направлен запрос на определение дальнейшей тактики лечения.
Пациентка была вызвана на очную консультацию в центр для дообследования и подтверждения диагноза.
Дифференциальный диагноз включал помимо ГКО:
-
Гиперпаратиреоз
-
Ассоциированное с синдромом Нунана множественное гигантоклеточное поражение костей скелета
-
Нейрофиброматоз I типа
-
Синдром Яффе – Кампаначчи
-
Фиброзная дисплазия
При очном осмотре симптомов нейрофиброматоза выявлено не было (см. рис 4,5).
Рис.4
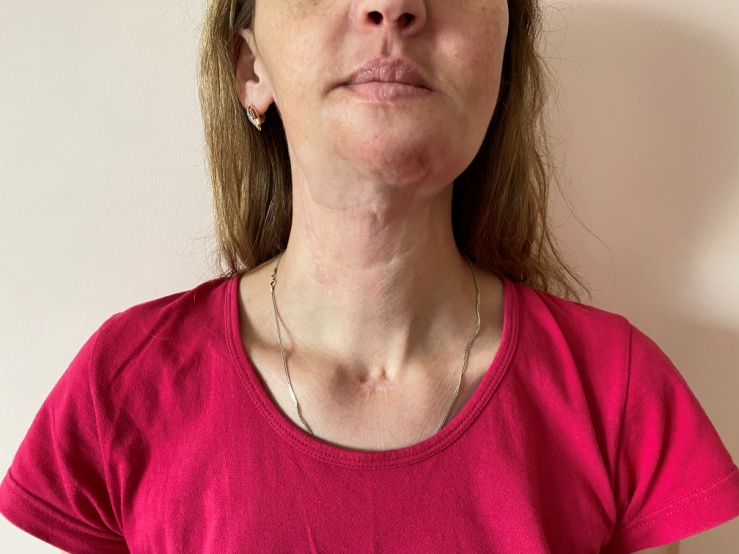
Рис.5
Результаты дообследования:
-
Уровень кальция в крови -1.24 ммоль/л
-
Уровень кальция в моче (суточная экскреция) - 4.43 ммоль/сут
-
Уровень паратгормона - 3.60 пмоль/л
-
G34W - отрицательно
Была выполнена дополнительная биопсия из седьмого грудного позвонка, пересмотр гистологии первичной и повторной, и рентгенологическая оценка эффекта на фоне терапии деносумабом. Соответственно были исключены: ГКО, гиперпаратиреоз, ассоциированное с синдромом Нунана множественное гигантоклеточное поражение костей скелета, нейрофиброматоз I типа, синдром Яффе – Кампаначчи… Был собран мультидисциплинарный консилиум с привлечением патоморфологов и рентгенологов, на данном этапе нами был предположен диагноз полиостальной формы фиброзной дисплазии – следующий относительно часто встречающийся в костях процесс, который может иметь множественный характер. В литературе имеются единичные описания случаев лечения фиброзной дисплазии деносумабом, при этом в данных публикациях не рассматривается рентгенологический ответ опухоли на проводимое лечение, оценен только клинический эффект в виде уменьшения болевого синдрома. Кроме того, большая часть данных пациентов до терапии деносумабом получала лечения бисфосфонатами, что также не позволяет адекватно оценить изменения в опухоли.
Фиброзная дисплазия (ФД) — заболевание скелета, вызванное соматическими активирующими мутациями белка, регулирующего цАМФ, Gsα. Эти мутации приводят к замене нормальной кости пролиферативными остеогенными предшественниками, что приводит к деформации, переломам и боли. Современное лечение ФД является паллиативным. Хирургическое вмешательство часто необходимо для устранения деформации и перелома, но оно часто неэффективно в условиях выраженного распространения опухоли. Исследования с бисфосфонатами показали последовательное снижение боли при ФД. Для дальнейшего определения роли бисфосфонатов в лечении ФД необходимы дополнительные плацебо-контролируемые исследования, однако в настоящее время их основное показание ограничивается облегчением боли, связанной с ФД.
Лиганд RANK (RANKL) представляет собой белок клеточной поверхности, участвующий во многих клеточных процессах, включая остеокластогенез, и, как сообщается, сверхэкспрессируется в ФД-подобных костных клетках. Деносумаб представляет собой гуманизированное моноклональное антитело к RANKL, одобренное для лечения остеопороза и профилактики заболеваний скелета, вызванных метастазами в костях или ГКО. RANKL экспрессируется остеогенными клетками, включая остеобласты, и играет ключевую роль в остеокластогенезе. Связываясь со своим рецептором на мембранах предшественников остеокластов, RANKL способствует дифференцировке остеокластов и в конечном итоге приводит к усилению резорбции кости. Помимо своей роли в остеокластогенезе, RANKL также играет роль в онкогенезе как в нескелетных, так и в скелетных тканях. Последние данные свидетельствуют о том, что развитие скелетных новообразований зависит от активации как RANKL, так и цАМФ/протеинкиназы А. Недавно было показано, что ингибирование RANKL с помощью деносумаба эффективно при лечении гигантоклеточных гранулем костей, которые, как и ФД, происходят из стромальных клеток костного мозга. Поэтому ингибирование RANKL является перспективным в качестве потенциальной терапии ФД.
С учетом положительного клинического эффекта, а также рентгенологического эффекта в виде консолидации перелома грудины, лечение было продолжено, но переведено на поддерживающую схему в виде укола 1 раз в 3 мес. Решение о переходе на поддерживающую схему связано с возможными рисками в виде остеонекроза челюсти. При этом у пациентки уже скомпрометирована и верхняя и нижняя челюсть (предшествующие вмешательства). Пациентка продолжает получать деносумаб в поддерживающей схеме с сохранением эффекта, при этом поддерживающая схема в настоящее время представляет собой укол деносумаба в 60мг п/к 1 раз в 6 мес.
Этот случай демонстрирует важность мультидисциплинарного консилиума и определения диагноза и тактики лечения в профильном центре.
Boyce AM, Chong WH, Yao J, et al. Denosumab treatment for fibrous dysplasia. J Bone Miner Res. 2012;27(7):1462-1470. doi:10.1002/jbmr.1603
Eller-Vainicher C, Rossi DS, Guglielmi G, et al. Prompt clinical and biochemical response to denosumab in a young adult patient with craniofacial fibrous dysplasia. Clin Cases Miner Bone Metab. 2016;13(3):253-256. doi:10.11138/ccmbm/2016.13.3.253
Krishna Prabha Gautam, Remya Rajan, Kripa Elizabeth Cherian, Nitin Kapoor, Julie Hephzibah, Thomas Vizhalil Paul, A case of recalcitrant fibrous dysplasia treated with denosumab, Joint Bone Spine, Volume 87, Issue 4, 2020, Pages 369-370, ISSN 1297-319X, https://doi.org/10.1016/j.jbspin.2020.03.007.
Автор: к.м.н. Тарарыкова А.А.


Комментарии (0)