Рабдомиосаркома (RMS) является наиболее распространенной саркомой мягких тканей среди детей и молодых взрослых. Случаи РМС составляют примерно 50% всех сарком мягких тканей у детей и 8% от всех новообразований у детей. Классификация опухолей мягких тканей и костей от ВОЗ подразделяет RMS на четыре подтипа: эмбриональный (ERMS), альвеолярный (ARMS), плеоморфный и веретеноклеточный/склерозирующий подтип, каждый из которых имеет свои генетические, гистологические и клинические особенности. Двумя основными формами RMS являются ERMS и ARMS, при этом 2/3 всех случаев RMS диагностируются как ERMS. ARMS обычно встречаются как у детей, так и у молодых взрослых. Этот подтип часто является результатом хромосомных транслокаций t(2;13)(q35;q14) или t(1;13)(q36;q14), на долю которых приходится примерно 60% или 20% случаев соответственно. Эти транслокации вызывают слияние между генами парных боксов (PAX), PAX3 или PAX7, и 3'-концом локуса Forkhead box O1 (FOXO1), расположенного на хромосоме 13. Продукты слияния белков PAX3-FOXO1 или PAX7-FOXO1 являются онкогенными и способствуют образованию ARMS. Однако примерно 20% ARMS являются негативными по слиянию, несмотря на классический альвеолярный фенотип. Это затрудняет определение того, представляет ли ARMS несколько клинических и биологических заболеваний, которых объединяет общий фенотип…?
Современные комбинированные схемы лечения, сочетающие применение операции, лучевой терапии и химиотерапии, улучшили общую 5-летнюю выживаемость. Тем не менее, 5-летняя выживаемость для ERMS и ARMS остается примерно на уровне 67% и 49% соответственно. Более того, среди случаев RMS, при которых на момент постановки диагноза имеются метастазы, 3-летняя бессобытийная выживаемость составляет немногим более 30%, на которую к тому же оказывает значительное и неблагоприятное влияние альвеолярный гистологический подтип.
АЛЬВЕОЛЯРНАЯ РАБДОМИОСАРКОМА. ПАТОМОРФОЛОГИЧЕСКИЕ И МОЛЕКУЛЯРНЫЕ ОСОБЕННОСТИ.
Типичным проявлением для ARМS являются фиброваскулярные перегородки, выстланные плотно упакованными яйцевидными или круглыми опухолевыми клетками и разделенные псевдоальвеолярными пространствами, отдаленно напоминающими легочные альвеолы. Часто в эти псевдоальвеолярные пространства выбрасываются «рыхло спаянные» рабдомиобласты. Менее дифференцированная АRMS может демонстрировать лишь намек на мелкие трещины или микроальвеолы, в таких случаях молекулярные методы могут помочь в диагностике.
Ранее наличия любого альвеолярного архитектурного паттерна было достаточно, чтобы классифицировать опухоль как АRMS. Однако в протоколах лечения комитета по саркомам мягких тканей детской онкологической группы рекомендует для подтверждения диагноза следующие критерии: преобладание (> 50) альвеолярного компонента, наличие перестройки FOX01 и t(1;13) или t(2;13), выявленной с помощью FISH или RT-PCR (ПЦР с обратной транскрипцией).
Фактически, протоколы лечения предназначены для того, чтобы подчеркнуть статус слияния путем исключения пациентов с альвеолярной гистологией, у которых нет слияния в группе промежуточного риска.
В одном исследовании COG (детская онкологическая группа) транскрипты слияния PAX3-FOXO1 и PAX7-FOXO1 были идентифицированы в 55 и 22% АRMS соответственно, в то время как 23% были отрицательными по слиянию. Идентификация слияния гена может быть особенно полезной для опухолей с сомнительными результатами световой микроскопии и иммуногистохимии (ИГХ).
Тип слияния гена имеет клиническое значение. Пациенты с транслокацией PAX7-FOXO1, как правило, моложе и чаще имеют поражение МТК конечностей, и у них может быть лучший исход по сравнению с пациентами с транслокацией PAX3-FOXO1.
Существуют дополнительные редкие транслокации и генетические аномалии, описанные при ARMS. Относительно редкие новые транслокации включают PAX3/FOXO4, PAX3/NCOA1, PAX3/NCOA2, FOXO1/FGFR1, FUS/TFCP2 и EWSR1/TFCP2. Кроме того, были выявлены амплификация CDK4, мутации в TP53, CDKN2A, CDKN2B и FGFR4, а также увеличение числа копий ALK. Как мутации-супрессоры опухоли (RASSF, HIC1, CASP8), так и метилирование ДНК играют роль в патогенезе ARMS.
ОСОБЕННОСТИ ЛЕЧЕНИЯ АЛЬВЕОЛЯРНОЙ РАБДОМИОСАРКОМЫ
Пациенты с ARMS и отрицательным статусом слияния FOXO1 имеют благоприятные результаты выживанмости, которые аналогичны пациентам с эмбриональной гистологией и отрицательным статусом слияния FOXO1.
Большинство таких пациентов будут принадлежать к категории низкого или среднего риска. Однако решение о назначении стандартной химиотерапии в этой группе должно основываться как для группы среднего риска, учитывая предполагаемые наилучшие результаты. Поэтому в детской онкологической практике лечат более высокими суммарными кумулятивными дозами циклофосфамида (как в протоколе D9803). Пациенты также имеют право на участие в программе ARST1431 и могут получать режим VAC/VI с темсиролимусом или без него. В соответствии с тем же протоколом пациенты с низким риском в детской онкологической практике получают терапию VAC/VA в соответствии со схемой A протокола ARST0331.
Согласно рекомендациям NCCN пациентам старше 18л при НЕплеоморфном типе рабдомиосаркомы проводятся режимы ХТ как для пациентов с саркомой Юинга - VAC / IE - альтернирующие курсы комбинаций циклофосфамида, доксорубицина, винкристина и ифосфамида, этопозида. Данная комбинация демонстрирует высокую активность в лечении мелкоклеточных сарком. Учитывая редкость вышеуказанных гистологических типов, имеются очень ограниченные данные (в основном ретроспективные) по ведению взрослых пациентов с рабдомиосаркомой. Во всех этих исследованиях использовалось комбинированное лечение (операция, лучевая терапия и химиотерапия). Более подробная тактика лечения данной когорты больных указана в рекомендациях по лечению саркомы Юинга. Схемы химиотерапии, используемые у взрослых с неплеоморфной рабдомиосаркомой или экстраоссальной саркомой Юинга / PNET, основаны на клинических исследованиях и данных из онкопедиатрии с учетом того, что возраст старше 18 лет является одним из прогностически неблагоприятных факторов.
ФАКТОРЫ ПРОГНОЗА ПРИ АЛЬВЕОЛЯРНОЙ РАБДОМИОСАРКОМЕ
ARMS среди взрослых встречается крайне редко. Наиболее распространенной первичной локализацией ARMS у взрослых являются глубокие мягкие ткани конечностей.
Благодаря клиническим исследованиям и интенсифицированным стратегиям лечения результаты лечения детей и подростков с RMS значительно улучшились за последние несколько десятилетий. Напротив, прогноз RMS среди взрослых все еще остаётся неблагоприятным. Исследования показывают 5-летнюю общую выживаемость 27% при RMS у взрослых по сравнению с 61% при RMS у детей.
Неблагоприятный прогноз при RMS у взрослых можно объяснить многими причинами. Во-первых, взрослые пациенты с RMS часто имеют далеко зашедшую клиническую картину. Согласно одному из исследований, более 60% взрослых пациентов с RMS имели регионарные или отдаленные метастазы при постановке диагноза. Более того, у взрослых с RMS наблюдается значительная частота метастатического прогрессирования, меньшая переносимость лечения и, как следствие, более низкая терапевтическая доза химиопрепаратов. Кроме того, у взрослых с RMS существуют неблагоприятные гистопатологические подтипы или анатомические локализации по сравнению с детскими пациентами, и, что важно, стандартная стратегия лечения еще не установлена. Недавние исследования с RMS в основном включали пациентов с детьми и подростками. Комбинированное лечение, включающее химиотерапию и хирургическое вмешательство с облучением или без него, стало стандартным лечением для этой группы пациентов. Тем не менее, лечение RMS у взрослых еще не разработано. В большинстве случаев RMS у взрослых выполняется хирургическое вмешательство, а химиотерапия и лучевая терапия используются в качестве дополнения к педиатрическому протоколу лечения, который в значительной степени зависит от опыта врача. Более того, возраст, размер опухоли, инвазивность, метастазирование, поражение регионарных лимфатических узлов и патоморфологический ответ после химиотерапии являются факторами, влияющими на прогноз RMS.
РЕЦИДИВ АЛЬВЕОЛЯРНОЙ РАБДОМИОСАРКОМЫ
При рецидиве ARMS любая схема субоптимальна, и лучшая еще не определена. Если это возможно, следует рассмотреть локальный контроль (например, хирургическое вмешательство).
У пациентов с изначально низким риском, которых лечили только схемой VAC/IE или коротким курсом VAC, возможно возобновление режима VAC (с высокими дозами циклофосфамида), который может быть излечивающим... Другие варианты включают комбинации доксорубицина, ифосфамида и этопозида; доксорубицин, ифосфамид, месна и дакарбазин; циклофосфамид плюс топотекан; винорелбин, циклофосфамид и темсиролимус; иринотекан плюс винкристин, с темозоломидом или без него; чередование циклофосфамида/доксорубицина и ифосфамида/этопозида, и др.
У пациентов с очень низким шансом на излечение (пациенты с рецидивом высокого или промежуточного риска, получающие максимальную стандартную терапию с лучевой терапией для локального контроля) рекомендовано использовать схемы, которые не будут существенно влиять на качество жизни, включая винорелбин и циклофосфамид (с темсиролимусом или без него), только винорелбин или топотекан плюс циклофосфамид.
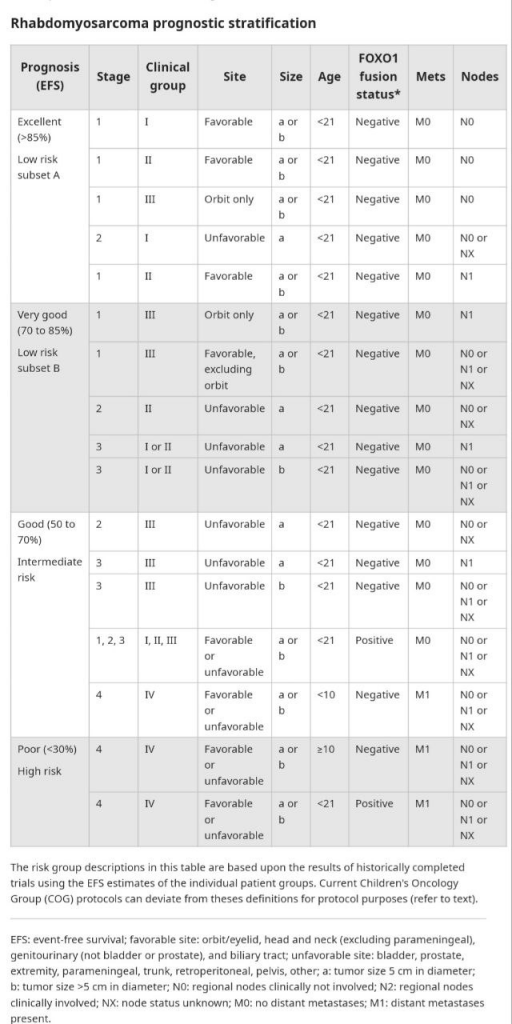
ТАБЛИЦА ПО СТРАТИФИКАЦИИ СТЕПЕНИ РИСКА ДЛЯ РАБДОМИОСАРКОМЫ
Стоит помнить, что в отношении взрослых пациентов эта стратификация достаточно размыта.
ЧТО НОВОГО В ЛЕЧЕНИИ АЛЬВЕОЛЯРНОЙ РАБДОМИОСАРКОМЫ?
Таргетная мишень KDM4 для лечения альвеолярной рабдомиосаркомы, ассоциированной с PAX3-FOXO1
Химерные факторы транскрипции управляют клонально-специфическим онкогенезом, но, как известно, их трудно выбрать у качестве таргетной мишени. Как ранее мы писали, для АRMS характерно слиние белка PAX3-FOXO1, который управляет сетью основных регуляторных цепей факторов транскрипции.
В этой работе (2022г) авторы показали, что гистон-лизиндеметилаза 4B (KDM4B) может быть терапевтической мишенью для PAX3-FOXO1 у RMS. Генетическое и фармакологическое ингибирование KDM4B существенно замедляло рост опухоли. Подавление белков KDM4 ингибировало экспрессию основных онкогенных факторов транскрипции и вызывало эпигенетические изменения суперэнхансеров, регулируемых PAX3-FOXO1. Сочетание ингибирования KDM4 с цитотоксической химиотерапией приводило к регрессии опухоли в доклинических моделях подкожного ксенотрансплантата PAX3-FOXO1+ RMS.
Эта работа дает надежду, что патогенетический подход в лечении каждого типа и даже подтипа саркомы может быть найден!
doi: 10.1126/scitranslmed.abq2096. Epub 2022 Jul 13. PMID: 35857643; PMCID: PMC9548378
SMARCA4 при альвеолярной рабдомиосаркоме
Появляющиеся данные подтверждают роль эпигенетической дисрегуляции в RMS. В это работе авторы показалм, что SMARCA4/BRG1 , АТФ-зависимый фермент ремоделирования хроматина комплекса SWI/SNF, заметно экспрессируется в первичных опухолях у пациентов с ARMS, а также в клеточных культурах. Валидированные данные скрининга CRISPR 400 эпигенетических мишеней определили SMARCA4 как уникальный фактор долгосрочного выживания опухолевых клеток в ARMS. Расщепитель белка SMARCA4/SMARCA2 (ACBI-1) продемонстрировал аналогичную долгосрочную зависимость опухолевых клеток in vitro и in vivo.
Эти результаты показывают, что SMARCA4 может быть фактором зависимости опухолевых клеток и предполагаемой терапевтической мишенью для ARMS.
PS. Почему данные работы нам важны, и мы за ними следим??
Несмотря на то, что мы их называем "предполагаемыми.... возможными.." терапевтическими мишенями, и когда они не срабатывают, мы не расстраиваемся... Наверное тут могут понять охотники или рыбаки, которым знакома тактика выжидания... Даже отрицательные результаты могут помочь нам размотать сложный клубок патогенеза и биологии конкретного подтипа саркомы и лучше ее понятьdoi: 10.1038/s41388-022-02205-0. Epub 2022 Jan 29. PMID: 35094009; PMCID: PMC9985831.

