Авт. А.А. Тарарыкова, к.м.н., врач онколог.
Начнем, пожалуй, с сухой выжимки по тому, что у нас есть из существующих рекомендаций.
Миоэпителиома, миоэпителиальная карцинома и миксоидная/смешанная опухоль мягких тканей представляют собой группу редких новообразований, которые имеют общие морфологические, иммунофенотипические и генетические особенности со своими аналогами в слюнных железах и коже.
Миоэпителиальная карцинома характеризуется умеренной и высокой ядерной атипией, повышенной митотической активностью и некрозом.
Отмечается положительное окрашивание S100, EMA, кератина или GFAP.
Рекомендуемое кодирование по МКБ-О:
8982/0 - Миоэпителиома, БДУ
8982/3 - Миоэпителиальный рак
8940/0 - Смешанная опухоль, БДУ
8940/3 - Опухоль смешанная, злокачественная
По МКБ-11:
2F7C и XH3CQ8 — Новообразования соединительной или других мягких тканей неопределенного характера и миоэпителиома.
Эпидемиология
- Равное распределение между полами и широкий возрастной диапазон (средний возраст: 40 лет) (Am J Surg Pathol 1997; 21:13, Am J Surg Pathol 2003; 27:1183, Am J Surg Pathol 2007; 31:1813)
- Около 20% опухолей возникают в детском возрасте.
- Миоэпителиальная карцинома, по-видимому, непропорционально распространена среди детей (Am J Surg Pathol 2007;31:1813).
Локализация:
- Большинство миоэпителиальных опухолей локализуется в конечностях (Am J Surg Pathol 2003;27:1183, Am J Surg Pathol 2007;31:1813, Genes Chromosomes Cancer 2010;49:1114).
- Другие - на туловище, голове и шее (Am J Surg Pathol 2003; 27:1183).
- Редко опухоли располагаются в костях, внутренних органах или коже (Genes Chromosomes Cancer 2010;49:1114, Am J Surg Pathol 2013;37:960, Mod Pathol 2011;24:1444).
Этиология - опухоль возникает спорадически и этиология до сих пор неизвестна.
МИОЭПИТЕЛИАЛЬНАЯ КАРЦИНОМА
Клинические особенности:
- Миоэпителиома обычно представляет собой безболезненный узел различного размера, постепенно прогрессирующий рост, который обычно не вызывает клинических симптомов (Medicine (Baltimore) 2018;97:e11209, Case Rep Pathol 2020;2020:3747013).
Диагностика:
- Выполнение биопсии является золотым стандартом для окончательной диагностики.
- До 45% миоэпителиальных опухолей, возникающих в коже, мягких тканях и костях, содержат реаранжировку гена EWSR1 (и редко альтернативную реаранжировку FUS) (Genes Chromosomes Cancer 2010;49:1114, Head Neck Pathol 2015;9:32).
- КТ и МРТ показывают четко очерченную дольчатую опухоль с гетерогенно умеренным усилением (Medicine (Baltimore) 2018;97:e11209).
- ПЭТ с 18F-ФДГ показывает повышенное накопление 18F-ФДГ (AJR Am J Roentgenol 2006; 186: 270).
Прогностические факторы:
- Хотя большинство морфологически доброкачественных миоэпителиальных новообразований мягких тканей ведут себя доброкачественно, существует примерно 20% риск местного рецидива (Am J Surg Pathol 2003; 27:1183).
- Отдаленные метастазы морфологически доброкачественных миоэпителиальных новообразований встречаются редко (Am J Surg Pathol 2003;27:1183).
- Миоэпителиальные карциномы демонстрируют более агрессивное поведение: частота рецидивов составляет 39–42%, а отдаленные метастазы наблюдаются у 32–52% больных (Head Neck Pathol 2015; 9:32).
- Частые локализации метастазирования включают легкие, лимфатические узлы, кости и мягкие ткани (Am J Surg Pathol 2003;27:1183, Am J Surg Pathol 2007;31:1813).
Лечение:
- Стандартом лечения локализованной миоэпителиомы мягких тканей является хирургическая резекция с чистыми краями резекции, с пред/послеоперационным облучением злокачественных опухолей (Med Oncol 2019;37:13, Am J Clin Oncol 2018;41:357).
Не существует четко определенных или подтвержденных критериев классификации миоэпителиальной карциномы (Head Neck Pathol 2015; 9:32).
Было показано, что цитологическая атипия является единственным предиктором агрессивного поведения в мягких тканях (Am J Surg Pathol 2003; 27:1183).
МИОЭПИТЕЛИАЛЬНАЯ КАРЦИНОМА
Морфологические варианты:
- Кожно-синцитиальная миоэпителиома:
Под микроскопом опухоли демонстрируют сплошной пластинчатый рост от овоидных до веретенообразных или гистиоцитоидных клеток одинакового размера со бледно-эозинофильной синцитиальной цитоплазмой (Am J Surg Pathol 2013; 37:710).
- Смешанная опухоль:
Тубулопротоковая дифференцировка аналогична опухолям из слюнных желез (Head Neck Pathol 2015; 9:32)
- Миоэпителиальные карциномы с круглоклеточным недифференцированным компонентом:
Круглоклеточный недифференцированный компонент наблюдается до 10% миоэпителиальных карцином, возникающих у пациентов детского возраста (Am J Surg Pathol 2013; 37:710).
Характерное ИГХ – позитивное окрашивание:
- Кератин AE1/AE3, EMA, S100, кальпонин (Am J Surg Pathol 2003;27:1183, Am J Surg Pathol 2013;37:710, Head Neck Pathol 2015;9:273)
- GFAP, гладкомышечный актин, SOX10, p63 имеют тенденцию быть широко вариабельными (Am J Surg Pathol 2003;27:1183, Head Neck Pathol 2015;9:273).
- Кожная синцитиальная миоэпителиома имеет отчетливый иммунофенотип EMA и S100-позитивна, но нечасто отмечается окрашивание цитокератина (Am J Surg Pathol 2013;37:710).
- ИГХ-позитивный PLAG1 в 58–100% миксоидных/смешанных опухолей, но отрицательный при миоэпителиомах без дифференцировки протоков (Head Neck Pathol 2015; 9:32).
- Панель, включающая кератин AE1/AE3, EMA, S100 и GFAP, в большинстве случаев идентифицирует миоэпителиальную дифференцировку (Head Neck Pathol 2015; 9:32).
Характерное ИГХ – негативное окрашивание:
- CD34, ЭРГ
- Экспрессия SMARCB1/INI1 теряется в некоторых миоэпителиомах и миоэпителиальных карциномах (Am J Surg Pathol 2007;31:1813, Am J Surg Pathol 2009;33:542).
Молекулярно-цитогенетические особенности:
- Чаще всего перестраивается EWSR1, за которым следует FUS (Гены рака хромосом 2010;49:1114, Гены рака хромосом 2015;54:267, Гены рака хромосом 2020;59:348)
- Партнерами по слиянию являются: ATF1, KLF15, KLF17, PBX1, PBX3, POU5F1, VGLL1 и ZNF444 (Hum Pathol 2012;43:764, Am J Surg Pathol 2016;40:386, Гены рака хромосом 2008;47:558, Гены рака хромосом 2015;54:63, Гены рака хромосом 2010;49:1114, Гистопатология 2014;65:917, Гены рака хромосом 2020;59:249, Гены рака хромосом 2009;48:1051)
- Слияния EWSR1-POU5F1 связаны со злокачественной миоэпителиальной опухолью с гнездовым эпителиоидным ростом и четкой клеточной морфологией (Гены, хромосомы, рак 2020;59:348)
- Миоэпителиальные опухоли со слияниями EWSR1-PBX1/3 часто доброкачественны и ассоциированы с вялыми веретенообразными клетками и склеротической морфологией (Genes Chromosomes Cancer 2020;59:348)
- Слияния FUS-KLF17 связаны с хордомоподобной морфологией (Гены, хромосомы, рак 2020;59:348)
- Поверхностные опухоли и опухоли с дифференцировкой протоков имеют тенденцию генетически приближаться к смешанным опухолям / плеоморфным аденомам слюнной железы с перестройкой PLAG1 (Genes Chromosomes Cancer 2013;52:675)
- Сообщалось о новой перестройке SS18-POU5F1 в злокачественном круглоклеточном новообразовании с миоэпителиальным фенотипом (Гистопатология 2020;77:681)
МИОЭПИТЕЛИАЛЬНАЯ КАРЦИНОМА
Далее мы будем разбирать особенности опухоли и новые данные в диагностике и лечении...
Что-либо более-менее стоящее по редким опухолям найти сложно, и чаще всего мы натыкаемся на одни и те же работы. Нашла статью за 2020г (надо сказать – свежак, с учетом того, о чем идет речь), понравилась тем, что в принципе является демонстративной по тому, что происходит в реальной практике.
Chamberlain, F., Cojocaru, E., Scaranti, M. et al. Adult soft tissue myoepithelial carcinoma: treatment outcomes and efficacy of chemotherapy. Med Oncol 37, 13 (2020). https://doi.org/10.1007/s12032-019-1335-4
Основной целью этого исследования была оценка результатов лечения всех пациентов с миоэпителиальной карциномой мягких тканей, проходивших лечение в одном специализированном центре, а вторичной - установить эффективность системной терапии у пациентов с прогрессированием заболевания. Был проведен ретроспективный обзор базы данных отделения сарком в Royal Marsden (London, UK) в период с 1996 по 2019 год.
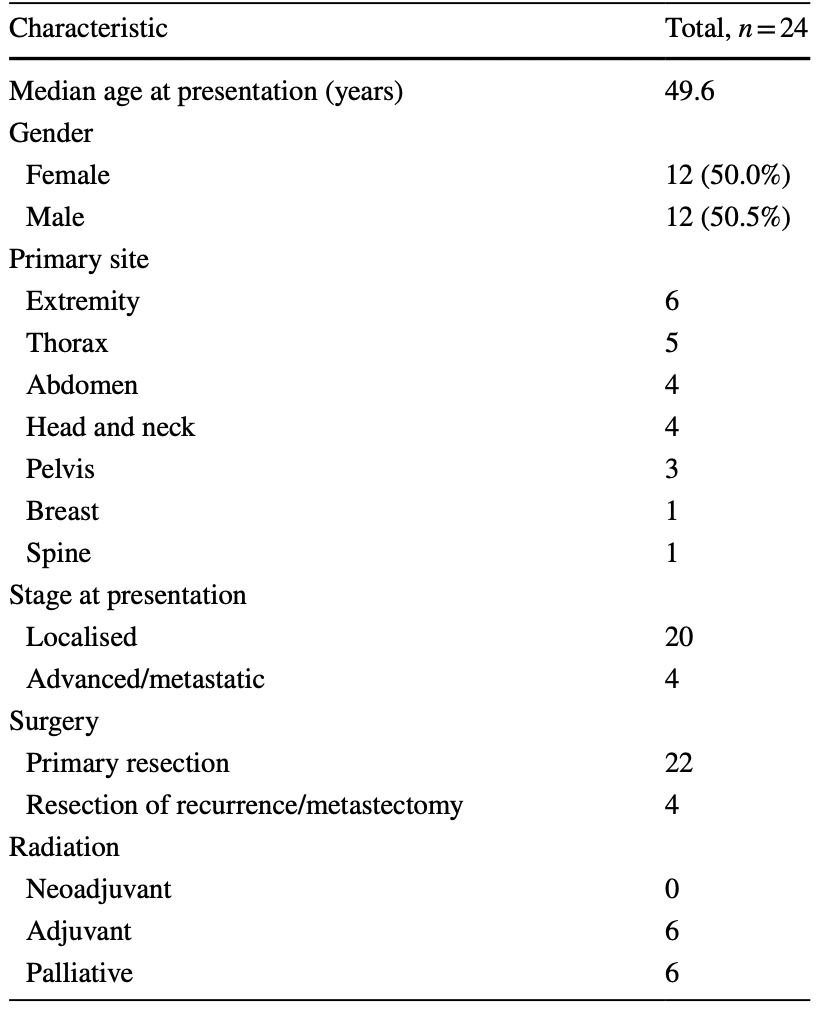
За 23 (!!!) года было набрано 24 пациента, проходивших лечение в данном учреждении: 12 мужчин и 12 женщин. Средний возраст на момент обращения составил 49,6 года.
Были исключены все первичные новообразования слюнных желез или миоэпителиальные новообразования слюнных желез, а также любые метастатические миоэпителиальные карциномы слюнных желез, поскольку они генетически отличаются. Один случай первичной злокачественной аденомиоэпителиомы молочной железы, хотя и возникшей из железистых, а не мягких тканей, был включен в исследование, поскольку этот подтип имеет многие клинические и гистопатологические признаки злокачественных миоэпителиальных опухолей мягких тканей. Наиболее ччастыми локализациями были конечности и грудная стенка. Медиана наблюдения составила 3,9 лет.
Семнадцать пациентов (70,8%) были классифицированы как имеющие миоэпителиальную карциному мягких тканей, шесть пациентов (25,0%) - как имеющие "злокачественную миоэпителиому" и у одного пациента (4,2%) была злокачественная аденомиоэпителиома молочной железы.
У двадцати пациентов (83,3%) заболевание было локализованное, из которых девятнадцати (95,0%) была проведена операция. За период исследования у тринадцати пациентов (54,2%) произошел последующий рецидив:
- 3 (23,1%) с местным рецидивом,
- 10 (76,9%) с появлением метастазов.
В когорте с рецидивом медиана наблюдения от первичной операции до первого рецидива составила 21 месяц (IQR 4,8–40,8 месяцев). У четырех пациентов (16,7%) были выявлены метастазы, из которых трем (75,0%) была проведена хирургическая резекция. Наиболее распространенной локализацией метастазирования были легкие (n=2, 8,3%).
МИОЭПИТЕЛИАЛЬНАЯ КАРЦИНОМА
Характеристика пациентов
Chamberlain, F., Cojocaru, E., Scaranti, M. et al. Adult soft tissue myoepithelial carcinoma: treatment outcomes and efficacy of chemotherapy. Med Oncol 37, 13 (2020). https://doi.org/10.1007/s12032-019-1335-4
МИОЭПИТЕЛИАЛЬНАЯ КАРЦИНОМА
ЛОКАЛЬНЫЙ КОНТРОЛЬ
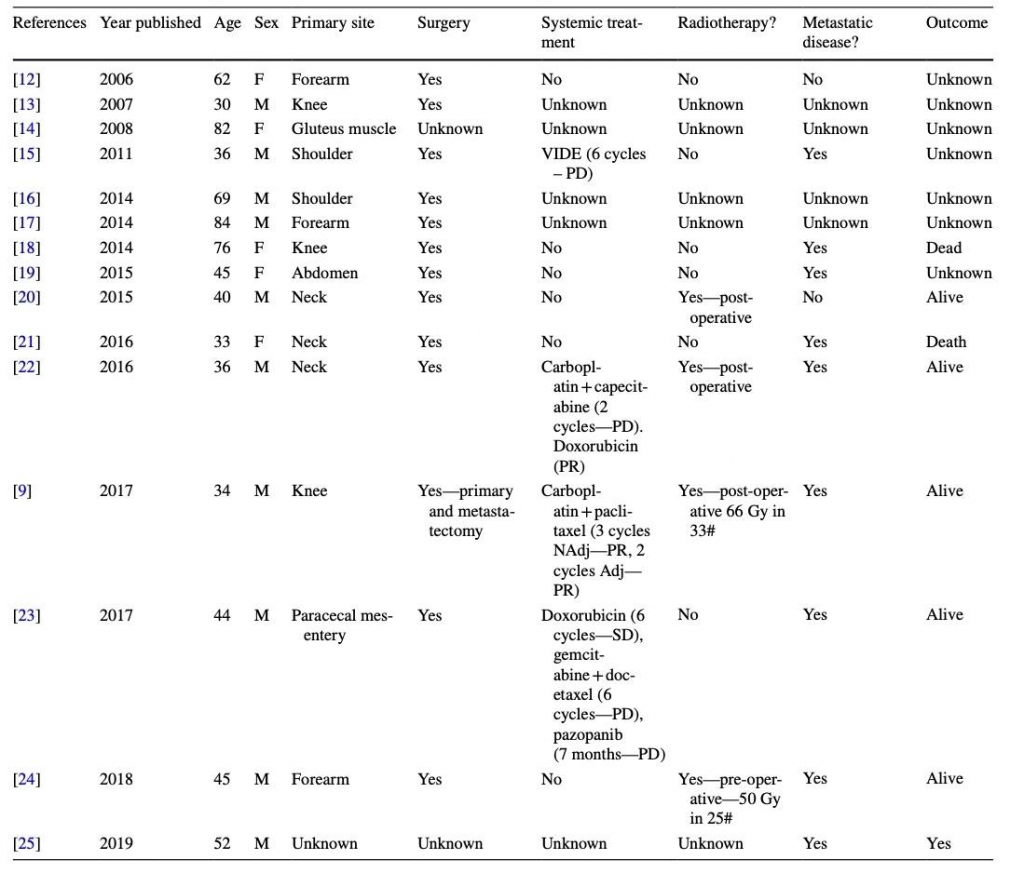
Двадцати двум из 24 пациентов (91,7%) первично было выполнено хирургическое лечение с удалением опухоли. Одиннадцати из 22 пациентов (50,0%) была выполнена резекция R0, в то время как 7 из 22 (31,8%) и 4 из 22 (18,2%) была выполнена резекция R1 и R2, соответственно (по результатам послеоперационной гистологии). Семи из 11 пациентов (63,6%) с резекцией R1 или R2 операция не проводилась в данной клинике, и 8 из 11 (72,7%) из этих пациентов операция не проводилась хирургом-специалистом по саркоме (что еще раз подтверждает важность лечения в специализированном центре!!!).
Из пациентов с резекцией R2, только 1 из 4 (25,0%) была проведена операция в саркомной клинике. Этому пациенту с резекцией R2, проходившему лечение в центре, было выполнено паллиативное удаление миоэпителиальной карциномы околоушных мягких тканей, которая появилась более чем через 20 лет после операции и лучевой терапии по поводу аденомы околоушной железы в том же месте. На момент операции у этого пациента были метастазы в легких небольшого размера в состоянии длительной стабилизации, и была проведена паллиативная операция по удалению околоушной массы. Впоследствии пациенту была проведена паллиативная лучевая терапия и химиотерапия. Пациент прожил 8,8 лет после паллиативной операции, но умер от прогрессирующего метастатического заболевания.
На момент анализа у 6 из 11 пациентов (54,5%) с резекцией R0, у 4 из 7 пациентов (57,1%) с резекцией R1 и у 3 из 4 (75,0%) с резекцией R2 произошел рецидив. Медиана наблюдения с момента постановки диагноза до смерти или последнего наблюдения при резекциях R0 и R1/R2 составила 5,5 лет и 4,0 года соответственно.
Двум пациентам (8,3%) была выполнена повторная операция через 2,6 и 14 месяцев по поводу местного рецидива. У первого пациента произошел второй рецидив через 8,4 месяца после повторной операции, и ему была начата системная химиотерапия. Другой пациент наблюдался в течение 22,6 месяцев после повторной операции, и на момент публикации у него не было второго рецидива.
Послеоперационное облучение было проведено 6 пациентам (25%) с суммарной дозой 30-65 Гр, по 2 Гр. Ни один из пациентов не получал предоперационную лучевую терапию. Медиана наблюдения с момента постановки диагноза до смерти или последнего наблюдения у пациентов, получавших послеоперационную лучевую терапию, составила 4,4 года.
Шесть пациентов (25,0%) получили паллиативную лучевую терапию (общая доза 20-55 Гр, по 2-3 Гр). Медиана наблюдения с момента постановки диагноза до смерти или последнего наблюдения за пациентами, получавшими паллиативную лучевую терапию, составила 5,3 год). Впоследствии все пациенты получали системную химиотерапию после паллиативной лучевой терапии. Ни одному из этих пациентов не проводилась изолированная перфузия конечностей или криоаблация.
Chamberlain, F., Cojocaru, E., Scaranti, M. et al. Adult soft tissue myoepithelial carcinoma: treatment outcomes and efficacy of chemotherapy. Med Oncol 37, 13 (2020). https://doi.org/10.1007/s12032-019-1335-4
МИОЭПИТЕЛИАЛЬНАЯ КАРЦИНОМА
ЛЕКАРСТВЕННОЕ ЛЕЧЕНИЕ
Девять пациентов (37,5%) получали паллиативную системную терапию по поводу метастатического заболевания после первичной операции, при этом среднее время от операции до первой системной химиотерапии составило 30,0 месяцев.
Среднее количество линий химиотерапии составило 2 (диапазон 1-4). В первой линии доксорубицин (либо в виде монотерапии, либо в комбинации) был назначен 5 из 9 (55,6%) пациентов. Три пациента (12,5%) были включены в клинические исследования первой фазы.
У одного (11%) пациента, получившего 6 циклов доксорубицина, наблюдался частичный ответ (PR). Пациентом был 33-летний мужчина с миоэпителиальной карциномой мягких тканей шеи. За первчной операцией последовала послеоперационная лучевая терапия. Местный рецидив и метастазы в легкие были диагностированы через 5,1 месяца после первичной операции. Пациент получил паллиативную химиотерапию первой линии карбоплатином и капецитабином в течение двух циклов в связи с прогрессированием заболевания. Далее была назначена химиотерапия второй линии доксорубицином (завершено 6 циклов), с частичным ответом и ВБП продолжительностью в 8,0 месяцев. Этот пациент погиб от заболевания через 4,1 года после постановки первоначального диагноза.
У шести из 9 пациентов (66,7%) стабилизация заболевания было наилучшим ответом на системное лечение первой линии. У одного пациента (11,1%) наблюдался длительный период (1,3 года) стабилизации при пероральном приеме циклофосфамида (200 мг один раз в день по расписанию на неделю) и преднизолона (20 мг один раз в день). Это была 63-летняя женщина, проходившая лечение по поводу злокачественной аденомиоэпителиальной карциномы левой молочной железы с метастазами в легкие. Пациентке ранее дважды удаляли первичную опухоль и удаляли метастазы по поводу заболевания грудной клетки. Выживаемость от постановки диагноза до смерти составила 3,7 года.
Медиана общей выживаемости для пациентов, получавших системное лечение, составила 2,7 года от первого рецидива до гибели или последнего наблюдения, а медиана ВБП при системной терапии первой линии составила 9,3 месяца.
Chamberlain, F., Cojocaru, E., Scaranti, M. et al. Adult soft tissue myoepithelial carcinoma: treatment outcomes and efficacy of chemotherapy. Med Oncol 37, 13 (2020). https://doi.org/10.1007/s12032-019-1335-4
МИОЭПИТЕЛИАЛЬНАЯ КАРЦИНОМА
Характеристика результатов лечения
Chamberlain, F., Cojocaru, E., Scaranti, M. et al. Adult soft tissue myoepithelial carcinoma: treatment outcomes and efficacy of chemotherapy. Med Oncol 37, 13 (2020). https://doi.org/10.1007/s12032-019-1335-4
МИОЭПИТЕЛИАЛЬНАЯ КАРЦИНОМА
ВАЖНО (!)
За период исследования три пациента (12,5%) были включены в клинические исследования первой фазы в данном профильном учреждении. Стабилизация заболевания была наилучшим результатом, достигнутым у 2 из 3 (66,6%) этих пациентов. В настоящее время не проводится клинических исследований, в которых конкретно участвовали бы только пациенты с диагнозом миоэпителиальная карцинома. Но, например, в исследовании II фазы по оценке эффективности таземетостата (пероральный высокоселективный ингибитор EZH) были включены пациенты с миоэпителиальной карциномой, те чаще всего данная нозология НЕ является диагнозом исключения для участия в исследовании….
МИОЭПИТЕЛИАЛЬНАЯ КАРЦИНОМА (МЭК) И ПРОТОННАЯ ТЕРАПИЯ
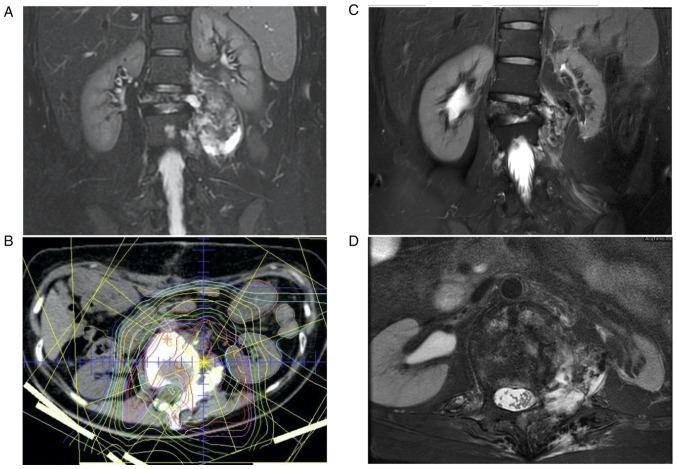
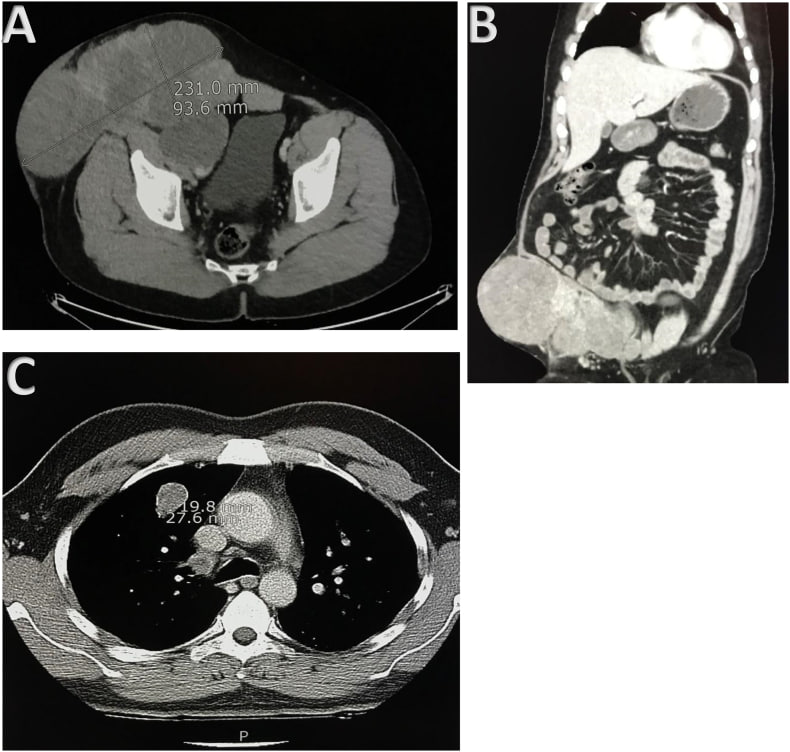
PS: первая картинка - после, вторая - до
Нашла интересный клинический случай. Интересен он тем, что подход при неоперабельной МЭК был как гистотип-НЕ-специфический стандарт для сарком мягких тканей.... те комбинация ифосфамида и доксорубицина + ЛТ... НО (!) тут была именно протонная терапия в качестве локального метода, что по имеющимся данным не обладает высокой эффективностью при мягкотканных саркомах, в отличие от костных...
А здесь - win-win! Мало того, что частичный ответ на 4 курса AI (!!!), так еще и без признаков рецидива спустя почти 9 лет от постановки диагноза...
Что это? Эффект удачной комбинации? Протонной терапии только? Напомню, для МЭК - наиболее часто рекомендуется адъювантная ЛТ. Конечно один случай не показателен, но ведь мы же говорим о редкой опухоли, так что стоит задуматься.
*Toki S, Nishisho T, Miyagi R, Bando Y, Sakaki M, Demizu Y, Okimoto T, Sairyo K. Combination chemotherapy of doxorubicin and ifosfamide with proton beam therapy for myoepithelial carcinoma originating in the paraspinal region: A case report and literature review. Mol Clin Oncol. 2022 Nov 3;17(6):163. doi: 10.3892/mco.2022.2596. PMID: 36482942; PMCID: PMC9716338.
МИОЭПИТЕЛИАЛЬНАЯ КАРЦИНОМА И ПАЗОПАНИБ
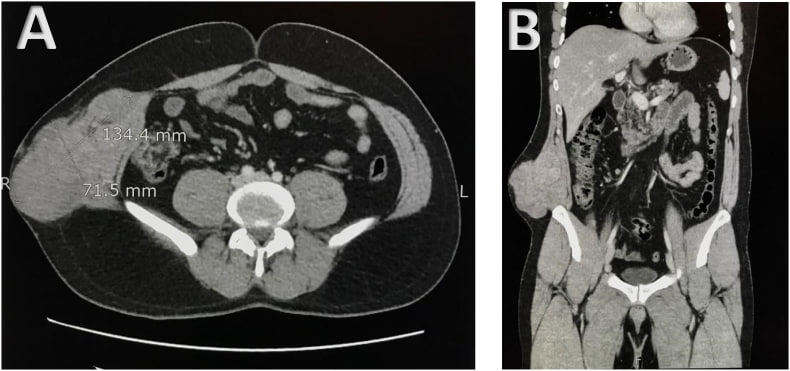
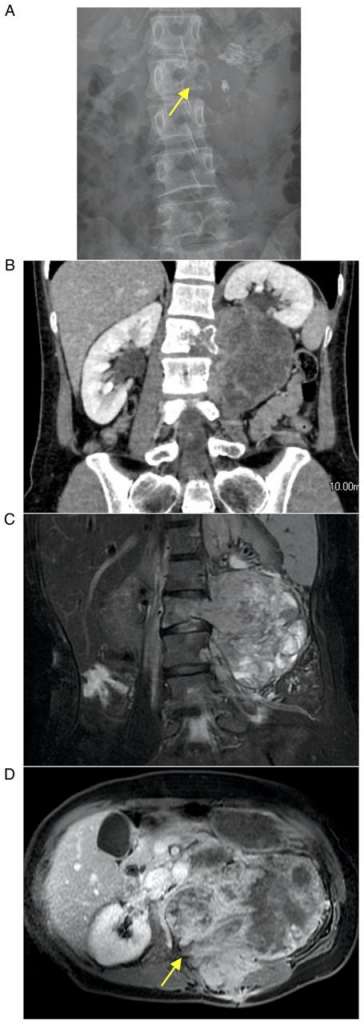
На первой картинке - май 2022г, когда было выявлено прогрессирование на фоне первой линии, на второй - до начала лечения
Один из показательных примеров, когда ингибиторы тирозинкиназ, как всегда, приходят нам на помощь!
Коллегами опубликован клинических случай пациента 37л с рецидивной местнораспространенной и метастатической (легкие+мягкие ткани) МЭК, после нескольких попыток операций настал момент, когда уже появились метастазы и только локальным контролем уже не поможешь... Пациенту было подробно рассказано о возможных схемах лечения МЭК и их побочных эффектов (NB! ВАЖНО), после чего совместным решением (пациент+доктор) остановились на пазопанибе (800мг ежедневно внутрь). Эффект продержался практически 3 года... Интересно, были ли перерывы или нарушения в приеме препарата, тк на какое-то время пациент выпал из поля наблюдения докторов и появился только в мае 2022г, когда был зарегистрировано дальнейшее прогрессирование опухоли. Из-за продолженного роста опухоли было предложено лечение по схеме CAP(цилофосфамид+доксорубицин+цисплатин).
О чем этот случай? Во-первых, пазопаниб был назначен в первую линию, что позволило отсрочить возможные побочные явления цитотоксических препаратов (например, кардиотоксичность при антрациклинах).
Второе вытекает из первого - всегда (!!) во всех сложных (читай - редких) случаях варианты лечения надо обсуждать совместно с пациентом и желательно его близкими родственниками...Когда все плюсы и минусы будут взвешены, а доверие между доктором и пациентом достигнуто, правильное решение найдет вас само.
А как же NGS? И тут он тоже есть, а точнее нет. Все имеющиеся патоморфологические образцы были подвергнуты NGS для выявления любой терапевтической мутации, к сожалению они не были выявлены.
PS. Не теряйтесь во время лечения! Так можно упустить раннее прогрессирование, или внести пробелы в оценке эффекта назначенной терапии.


Комментарии (0)