Десмоидная опухоль – десмоидная фиброма (ДФ) - редкая моноклональная фибробластическая пролиферация, характеризующаяся переменным и часто непредсказуемым клиническим течением. ДФ относится к промежуточному типу фибробластических опухолей, характеризующихся местно-деструирующим, инвазивным ростом, высоким потенциалом рецидивирования и отсутствием способности к метастазированию. ДФ представляют собой достаточно редкую патологию соединительной ткани с частотой 2—4 случая на 1 млн человек, они составляют не более 0,01—0,03% среди всех опухолей мягких тканей. ДФ развиваются из мышечно-апоневротических структур или рубцовой ткани в результате перенесенной травмы или хирургического вмешательства и могут встречаться в любой анатомической области человеческого организма. Выделяют абдоминальные ДФ, локализующиеся в мягких тканях передней брюшной стенки; интраабдоминальные, исходящие из мезенхимальных структур брыжейки кишки, забрюшинного пространства и малого таза, экстраабдоминальные, локализующиеся на голове, шее, конечностях, плечевом поясе, грудной стенке, поясничной области, а также с мультифокальным ростом.
В последние годы были предприняты усилия по стандартизации лечения этого заболевания. В настоящий момент применяют хирургическое вмешательство, лучевую терапию, лекарственную терапию, а также их сочетания.
В последнем крупном проспективном рандомизированном исследовании, сравнили первоначальную операцию с активным наблюдением. Результаты не показали какой-либо разницы в выживаемости без прогрессирования и долгосрочном контроле заболевания между пациентами, перенесшими операцию, и теми, кто лечился консервативным подходом. Кроме того, анатомическое расположение, по-видимому, влияло на течение заболевания. Среди пациентов с благоприятными локализациями, определяемыми как брюшная стенка, брюшная область, молочные железы, органы пищеварения и нижние конечности, 2-летняя выживаемость без прогрессирования была одинаковой у пациентов, получавших хирургическое лечение (70 %) и нехирургическое (63 %; р = 0,41). Среди пациентов с неблагоприятными локализациями, определяемыми как грудная стенка, голова и шея и верхняя конечность, 2-летний выживаемость без прогрессирования была значительно лучше у тех пациентов, которые лечились без хирургического вмешательства (52 %) по сравнению с теми, кто перенес первоначальную операцию (25 %; р = 0,001). [1]
Таким образом, Группой по изучению десмоидной опухоли (The Desmoid Tumor Working Group) предложено ведение бессимптомных пациентов с первоначальным наблюдением, независимо от локализации и размера опухоли под контролем опытной команды специалистов по опухолям соединительной ткани из референтного центра. Настоящим вводится термин “активное наблюдение”. Очевидно, что пациентов необходимо направлять в центры с опытом лечения ДФ, чтобы свести к минимуму риски активного наблюдения и избежать ненужной или калечащей операции. Оперативное вмешательство хирургов, не имеющих значительного опыта в лечении ДФ, настоятельно не рекомендуется. Аналогичным образом, во время постановки диагноза рекомендуется направление к опытным многопрофильным бригадам для получения оптимальных рекомендаций по безопасности стратегии первоначального наблюдения. [2]
Были опубликованы ретроспективные исследования [3-14], посвященные сочетанию хирургического вмешательства и лучевой терапии по сравнению с одним хирургическим вмешательством. Хотя при добавлении лучевой терапии наблюдалось некоторое снижение ожидаемого абсолютного риска рецидива после операции 37 % против 25 %), но снижение не является статистически значимым.
Частота прогрессирования заболевания после лучевой терапии аналогична частоте рецидивов после сочетания хирургического вмешательства и лучевой терапии (23 % против 22 %). Совсем недавно в качестве альтернативы хирургическому вмешательству при симптоматических/растущих опухолях, расположенных в критических местах, таких как голова и шея, плечевой пояс и т.д., использовалась лучевая терапия в умеренных дозах. [15-18] Этот метод может стать оптимальной альтернативой хирургическому вмешательству и может использоваться, если медикаментозная терапия недоступна или неактивна.
Суммируя данные, сравнивающие лучевую терапию с хирургическим вмешательством , ожидаемый абсолютный риск прогрессирования заболевания после одной только лучевой терапии составляет 19 % против 29% после одной только операции. [19]
Таким образом, когда требуется активное лечение ДФ, может быть рассмотрено хирургическое вмешательство в качестве терапии первой линии при условии, что ожидаемый риск рецидива после операции низкий. Это особенно применимо для расположения ДФ на брюшной стенке. Целью должна быть резекция широких (R0) микроскопических краев, но положительные (R1) микроскопические края могут быть приняты, когда возникает проблема с функциональными результатами. Однако, если ожидаются положительные микроскопические изменения, следует предпочесть другие методы лечения, а не хирургическое вмешательство.
Варианты системного лекарственного лечения ДФ включают антигормональную терапию, нестероидные противовоспалительные препараты (НПВП), ингибиторы тирозинкиназы (ТКИ) и “низкие дозы” или обычные схемы химиотерапии, включая липосомальный доксорубицин. [20, 21]
Из-за отсутствия сравнительных исследований все еще не возможно установить окончательную последовательность существующих системных вариантов лечения. В целом, разумно сначала применять менее токсичную терапию, а затем поэтапно вводить более токсичные агенты. Из множества возможных вариантов системного лечения предлагается выбор схемы лечения с учетом (1) уровня доказательств, (2) общей скорости ответа, (3) выживаемости без прогрессирования, (4) простоты введения и (5) ожидаемой токсичности вводимого препарата препарат, следующий 5-мерной модели. В качестве примера, в худшем случае с мезентериальной, потенциально опасной для жизни ДФ существует консенсус в отношении назначения более агрессивной терапии. Для ДФ характерен отсроченный ответ после завершения предшествующей терапии. Реакция на химиотерапевтические препараты, такие как липосомальный доксорубицин, была обнаружена даже через 6 месяцев после завершения лечения. Частичный ответ на иматиниб был достигнут после 19 месяцев лечения. Отсроченный ответ на торемифен был описан у 16% ответивших пациентов после отмены лечения в течение медианы 96 месяцев. Замедленный ответ на лечение после прекращения приема метотрексата/винорелбина был описан в 46 % случаев. Поэтому при оценке противоопухолевой активности любой терапии следует принимать во внимание предшествующую терапию. [22-40]
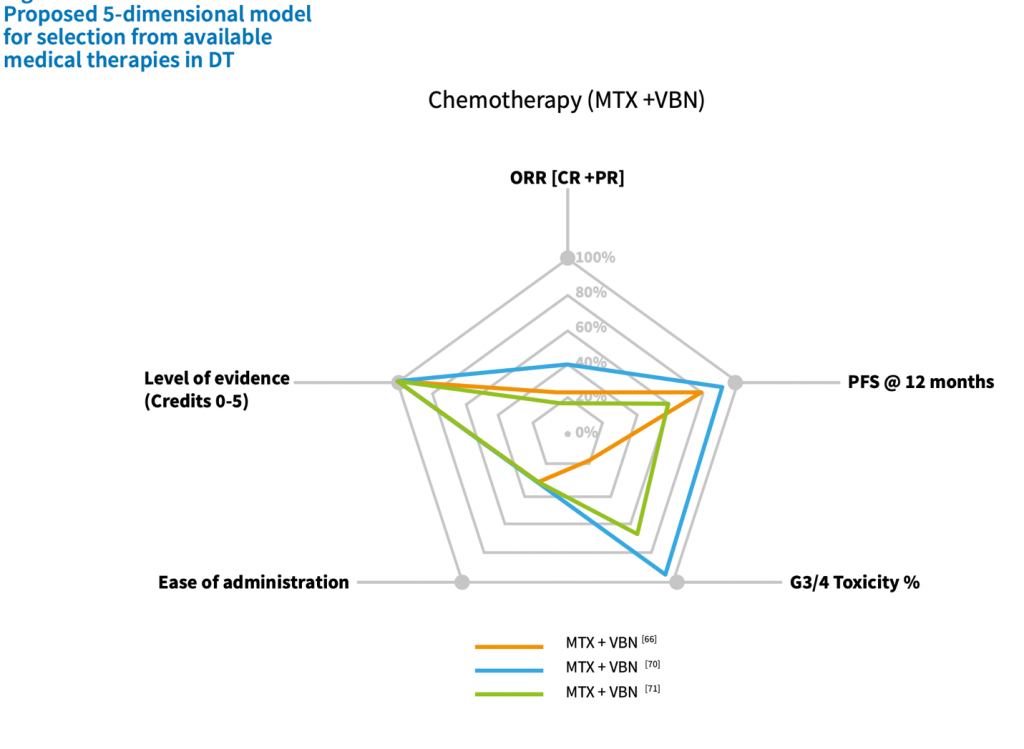
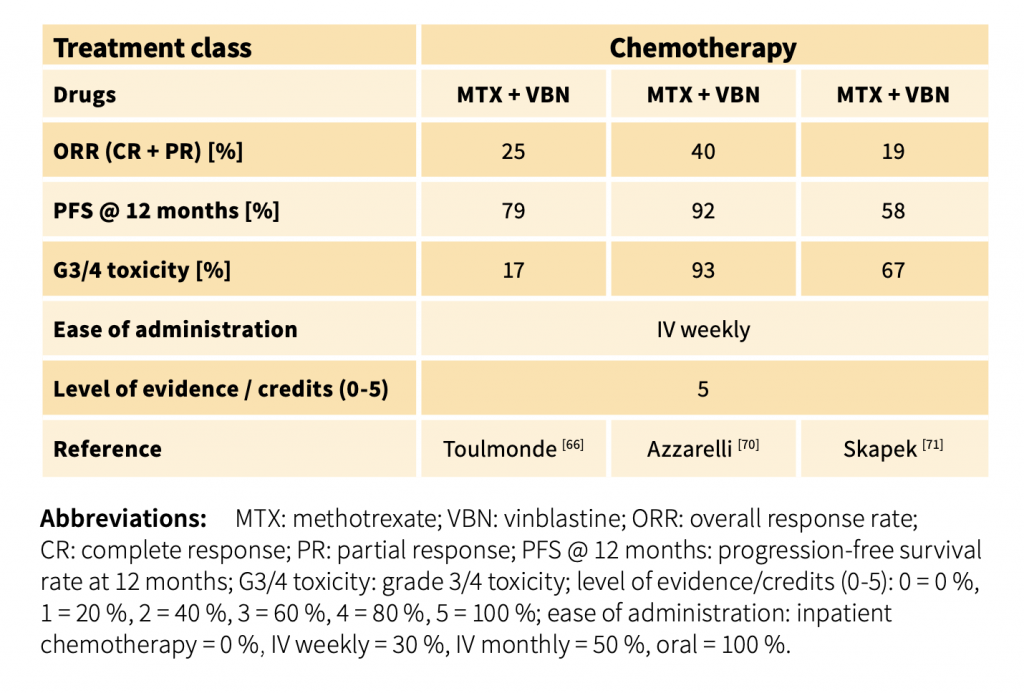
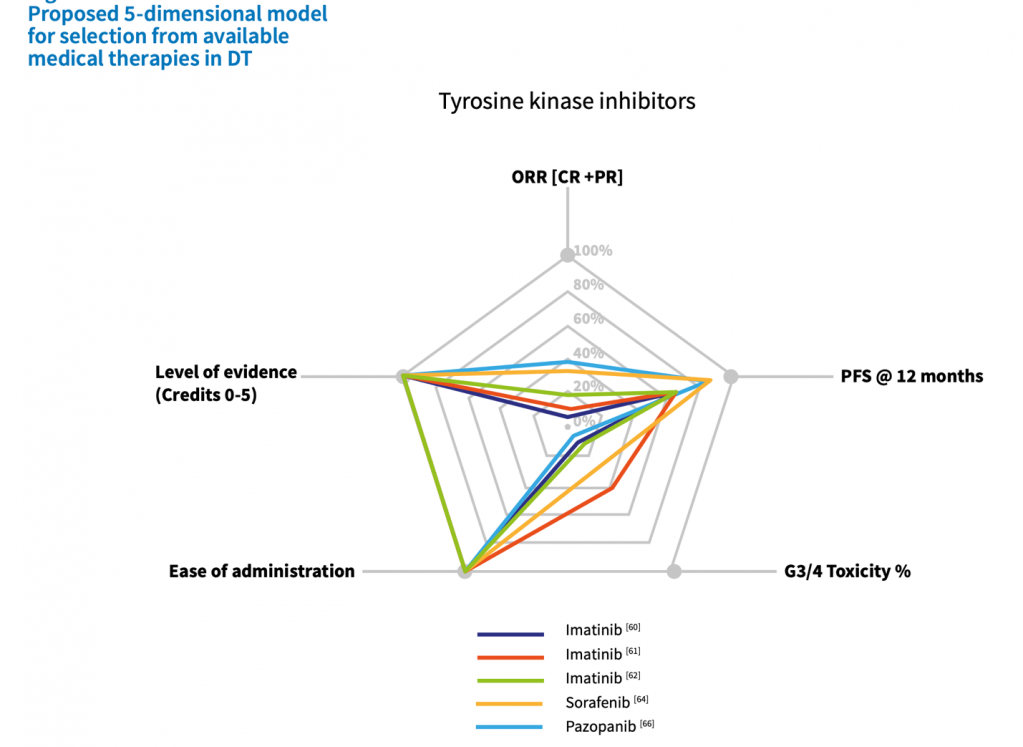
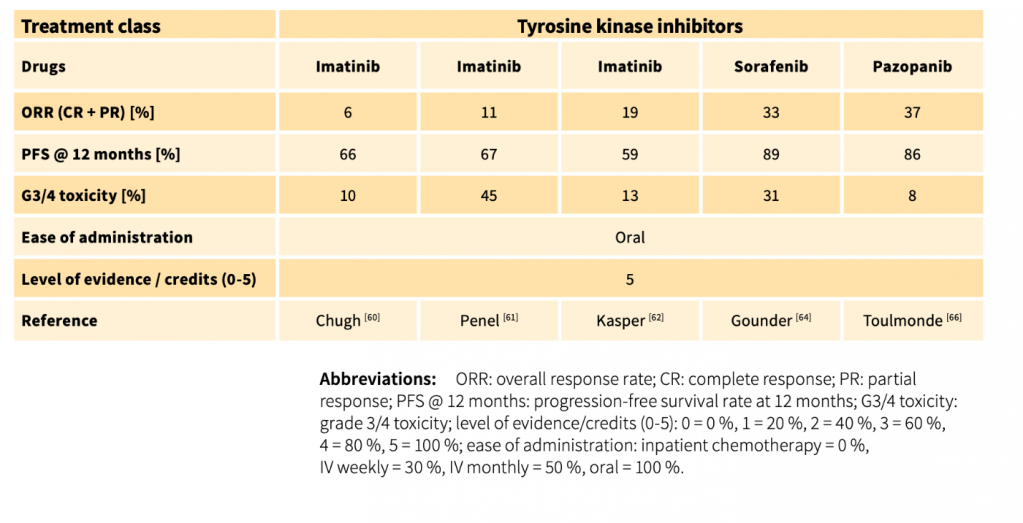
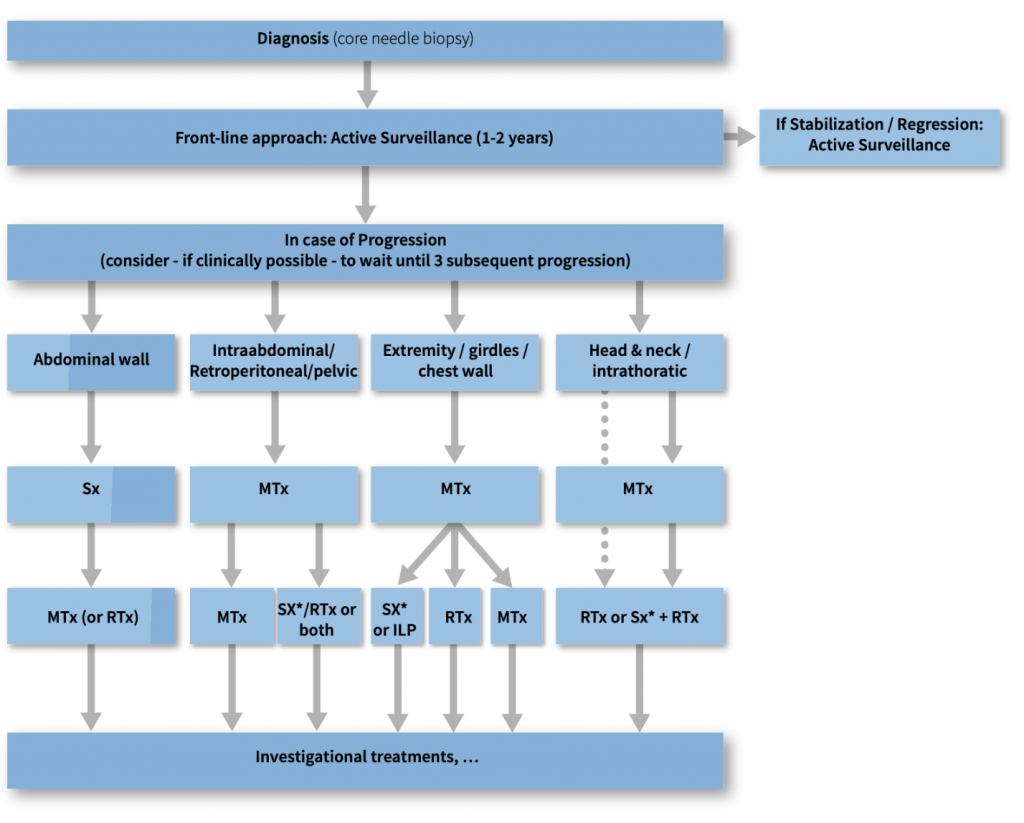
Первоначальный подход “активного наблюдения”, не влияет на эффективность последующих методов лечения. Таким образом, будучи осторожным и избегая потенциального вреда в опытных руках, этот подход в настоящее время считается первым шагом после постановки диагноза у большинства пациентов. Ни хирургическое вмешательство, ни другие формы активного лечения не предлагаются в качестве первичной терапии при постановке диагноза. Учитывая непредсказуемое течение заболевания, активное лечение следует рассматривать только в случае стойкого прогрессирования. Прогрессирование при однократном обследовании, особенно при отсутствии специфических симптомов и в некритических анатомических участках, само по себе не должно рассматриваться как показание к немедленному началу активного лечения. Активное наблюдение означает, что пациенты должны находиться под постоянным наблюдением с помощью МРТ-исследования (или альтернативно КТ, если МРТ невозможно) в течение 1-2 месяцев, затем с интервалом в 3-6 месяцев. Решение об активном лечении следует отложить до появления последующего прогрессирования или усиления выраженности симптомов, оцениваемого по крайней мере с помощью двух дополнительных обследований. Фактически, эта тактика позволяет избежать чрезмерного лечения у пациентов, которые могут спонтанно регрессировать, и препятствует лечению стабильных пациентов с невыраженной симптоматикой. Однако, когда опухоль локализуется близко к критическим структурам, котораые могут представлять значительную угрозу для жизни пациента (например, брыжеечная недостаточность или ДФ головы и шеи), может быть принято решение о раннем начале активной терапии, в связи с существующими высокими рисками угрозы жизни пациента. Как показано в алгоритме лечения на рисунке, тип дальнейшего лечения обычно определяется в зависимости от анатомического расположения, и решение должно приниматься с пациентами поэтапно: при ДФ брюшной стенки хирургическое вмешательство по-прежнему является первым шагом в случае прогрессирования. При внутрибрюшинной / забрюшинной/ тазовой ДФ системная терапия должна рассматриваться в качестве первого линии лечения. Для ДФ конечностей / пояса / грудной стенки, опять же, хирургическое вмешательство не должно быть основным выбором лечения; предпочтительно назначать медикаментозную терапию. Помимо хирургического вмешательства, лучевой терапии и медикаментозной терапии, дальнейшей стратегией лечения в этой области может быть изолированная перфузия конечностей. При ДФ головы и шеи / внутриторакальной ДФ медикаментозная терапия обычно считается вариантом первой линии. Однако при определенных условиях (пожилой возраст, непереносимость/предпочтения пациента, сопутствующие заболевания, быстро растущая опухоль, угрожающее жизненно важным органам и т.д.) лучевая терапия является разумной и эффективной альтернативой первой линии.
Автор:
Список Литературы:
1. Salas S, Dufresne A, Bui B et al. Prognostic Factors Influencing Progression-Free Survival Determined From a Series of Sporadic Desmoid Tumors: A Wait-and-See Policy According to Tumor Presentation. J Clin Oncol 2011; 29: 3553-3558.
2. Bernd Kasper, Peter Hohenberger, Alessandro Gronchi et al. The Management of Desmoid Tumors: A joint global evidence-based consensus guideline approach for adult and pediatric patients 2018
3. Baumert BG, Spahr MO, Von Hochstetter A et al. The impact of radiotherapy in the treatment of desmoid tumours. An international survey of 110 patients. A study of the Rare Cancer Network. Radiat Oncol 2007; 2: 12.
4. Gluck I, Griffith KA, Biermann JS et al. Role of radiotherapy in the management of desmoid tumors. Int J Radiat Oncol Biol Phys 2011; 80: 787-792.
5. Pignatti G, Barbanti-Brodano G, Ferrari D et al. Extraabdominal desmoid tumor. A study of 83 cases. Clin Orthop Relat Res 2000; 375: 207-213.
6. Goy BW, Lee SP, Eilber F et al. The role of adjuvant radiotherapy in the treatment of resectable desmoid tumors. Int J Radiat Oncol Biol Phys 1997; 39: 659-665.
7. Jelinek JA, Stelzer KJ, Conrad E et al. The efficacy of radiotherapy as postoperative treatment for desmoid tumors. Int J Radiat Oncol Biol Phys 2001; 50: 121-125.
8. Ma D, Li S, Fu R et al. Long-term outcomes of 47 patients with aggressive fibromatosis of the chest treated with surgery. Eur J Surg Oncol 2016; 42: 1693-1698.
9. Catton CN, O‘Sullivan B, Bell R et al. Aggressive fibromatosis: optimization of local management with a retrospective failure analysis. Radiother Oncol 1995; 34: 17-22.
10. Plukker JT, Van Oort I, Vermey A et al. Aggressive fibromatosis (non familial desmoid tumour): therapeutic problems and the role of adjuvant radiotherapy. Br J Surg 1995; 82: 510-514.
11. Duggal A, Dickinson IC, Sommerville S, Gallie P. The management of extra-abdominal desmoid tumours. Int Orthop 2004; 28: 252-256.
12. Karakousis CP, Mayordomo J, Zografos GC, Driscoll DL. Desmoid tumors of the trunk and extremity. Cancer 1993; 72: 1637-1641.
13. Kiel KD, Suit HD. Radiation therapy in the treatment of aggressive fibromatoses (desmoid tumors). Cancer 1984; 54: 2051-2055.
14. Miralbell R, Suit HD, Mankin HJ, Zuckerberg LR, Stracher MA, Rosenberg AE. Fibromatoses: from postsurgical surveillance to combined surgery and radiation therapy. Int J Radiat Oncol Biol Phys 1990; 18: 535-540.
15. Ballo MT, Zagars GK, Pollack A, Pisters PW, Pollack RA. Desmoid tumor: prognostic factors and outcome after surgery, radiation therapy, or combined surgery and radiation therapy. J Clin Oncol 1999; 17: 158-167.
16. Guadagnolo BA, Zagars GK, Ballo MT. Long-term outcomes for desmoid tumors treated with radiation therapy. Int J Radiat Oncol Biol Phys 2008; 71: 441-447.
17. Spear MA, Jennings LC, Mankin HJ et al. Individualizing management of aggressive fibromatoses. Int J Radiat Oncol Biol Phys 1998; 40: 637-645.
18. Rudiger HA, Ngan SY, Ng M, Powell GJ, Choong PF. Radiation therapy in the treatment of desmoid tumours reduces surgical indications. Eur J Surg Oncol 2010; 36: 84-88.
19. Acker JC, Bossen EH, Halperin EC. The management of desmoid tumors. Int J Radiat Oncol Biol Phys 1993; 26: 851-858.
20 Janinis J, Patriki M, Vini L et al. The pharmacological treatment of aggressive fibromatosis: a systematic review. Ann Oncol 2003; 14: 181-190.
21. Al-Jazrawe M, Au M, Alman B. Optimal therapy for desmoid tumors: current options and challenges for the future. Expert Rev Anticancer Ther 2015; 15: 1443-1458.
22. Skapek SX, Anderson JR, Hill DA et al. Safety and efficacy of high-dose tamoxifen and sulindac for desmoid tumor in children: results of a children’s oncology group (COG) phase II study. Pediatr Blood Cancer 2013; 60: 1108-1112.
23. Libertini M, Mitra I, van der Graaf et al. Aggressive Fibromatosis Response to Tamoxifen: Lack of correlation between MRI and Symptomatic Response. Clin Sarcoma Res 2018;
8: 13.
24. Chugh R, Wathen JK, Patel SR e al. Efficacy of imatinib in aggressive fibromatosis: Results of a phase II multicenter Sarcoma Alliance for Research through Collaboration (SARC) trial. Clin Cancer Res 2010; 16: 4884-4891.
25. Penel N, Le Cesne A, Bui BN et al. Imatinib for progressive and recurrent aggressive fibromatosis (desmoid tumors): an FNCLCC/French Sarcoma Group phase II trial with a long-term follow-up. Ann Oncol 2011; 22: 452-457.
26. Kasper B, Gruenwald V, Reichardt P et al. Imatinib induces sustained progression arrest in RECIST progressive desmoid tumors - final results of a phase II study of the German Interdisciplinary Sarcoma Group (GISG). Eur J Cancer 2017; 76: 60-67.
27. Gounder MM, Lefkowitz RA, Keohan ML et al. Activity of sorafenib against desmoid tumor / deep fibromatosis. Clin Cancer Res 2011; 17: 4082-4090.
28. Gounder MM, Mahoney MR, Van Tine BA, et al. Sorafenib for Advanced and Refractory Desmoid Tumors. N Engl J Med 2018; 379: 2417-2428.
29. Szucs Z, Messiou C, Wong HH et al. Pazopanib, a promising option in the landscape of treatment for aggressive fibromatosis. Anticancer Drugs 2017; 28: 421-426.
30. Toulmonde M, Ray-Coquard IL, Pulido M et al. DESMOPAZ: pazopanib (PZ) versus IV methotrexate/vinblastine (MV) in adult patients with progressive desmoid tumors (DT): a randomized phase II study from the French Sarcoma Group. J Clin Oncol 2018; 36 (suppl; abstr 11501).
31. Li S, Fan Z, Fang Z et al. Efficacy of vinorelbine combined with low-dose methotrexate for treatment of inoperable desmoid tumor and prognostic factor analysis. Chin J Cancer Res 2017; 29: 455-462.
32. Palassini E, Frezza AM, Mariani L et al. Long-term efficacy of methotrexate plus vinblastine / vinorelbine in large series of patients affected by desmoid-type fibromatosis. Cancer J 2017; 23: 86-91.
33. Constantinidou A, Jones RL, Scurr M, Al-Muderis O, Judson I. Advanced aggressive fibromatosis: Effective palliation with chemotherapy. Acta Oncol 2011; 50: 455-461.
34. Azzarelli A, Gronchi A, Bertulli R et al. Low-dose chemotherapy with methotrexate and vinblastine for patients with advanced aggressive fibromatosis. Cancer 2001; 92: 1259-1264.
35. Skapek SX, Ferguson WS, Granowetter L et al. Vinblastine and methotrexate for desmoid fibromatosis in children: results of a pediatric oncology group phase II trial. J Clin Oncol 2007; 25: 501-506.
36. Mir O, Rahal C, Rimareix F et al. Efficacy of oral vinorelbine in advanced/progressive desmoid tumours: An updated retrospective study in 50 patients. J Clin Oncol 2016; 34 (suppl; abstr 11050).
37. Ferrari A, Orbach D, Affinita MC et al. Evidence of hydroxyurea activity in children with pretreated desmoid-type fibromatosis: A new option in the armamentarium of systemic therapies. Pediatr Blood Cancer 2018; Sep 30:e27472 [Epub ahead of print].
38. de Camargo VP, Keohan ML, D‘Adamo DR et al. Clinical outcomes of systemic therapy for patients with deep fibromatosis (desmoid tumor). Cancer 2010; 116: 2258-2265.
39. Garbay D, Le Cesne A, Penel N et al. Chemotherapy in patients with desmoid tumors: a study from the French Sarcoma Group (FSG). Ann Oncol 2012; 23: 182-186.
40. Constantinidou A, Jones RL, Scurr M et al. Pegylated liposomal doxorubicin, an effective, well-tolerated treatment for refractory aggressive fibromatosis. Eur J Cancer 2009; 45: 2930-2934.


Комментарии (0)