Саркома Юинга (СЮ) является редкой круглоклеточной высокозлокачественной опухолью, которая, согласно классификации ВОЗ 2020 г., относится к группе недифференцированных мелкокруглоклеточных сарком костей и мягких тканей.
Саркома Юинга характеризуется слиянием гена EWS (EWSR1) на хромосоме 22q12 с различными членами семейства генов ETS (FLI1, ERG, ETV1, ETV4 и FEV). Слияние EWS и FLI1 на хромосоме 11 и соответствующая хромосомная транслокация t (11;22) (q24; q12) выявляется примерно у 85 % пациентов.
СЮ чаще встречаются у пациентов молодого возраста и составляют до 20 % всех первичных опухолей костей. Средний возраст при постановке диагноза составляет 15 лет, преобладают мужчины.
Наиболее распространенными первичными локализациями СЮ являются кости конечностей (50 %), за которыми следуют таз, ребра и позвонки.
Потенциально может поражаться любая кость, однако возможно и экстраскелетное происхождение, особенно среди взрослых (30 %).
СЮ в настоящее время считается отличной от более редких и недавно выявленных форм, таких как:
• круглоклеточная саркома с транслокацией химерного гена EWSR7‑non-ETS;
• саркома с перестройкой гена CIC (CIC–DUX4);
• саркома с перестройкой гена BCOR.
Среди мелкокруглоклеточных сарком при круглоклеточной саркоме с транслокацией химерного гена EWSR7‑non-ET отмечается преобладание мужчин, в основном пожилого возраста, поражаются чаще всего кости скелета.
Саркомы с перестройкой гена CIC в основном поражают мягкие ткани и редко кости.
Среди сарком с перестройкой гена BCOR вариант BCOR-CCNB3 встречается в основном в костях и преимущественно у пациентов детского возраста, тогда как BCOR с внутренней тандемной дупликацией был описан при опухолях мягких тканей у младенцев.
У 25 % пациентов при постановке диагноза выявляется отдаленное метастазирование. Наиболее частыми локализациями первичного очага являются кости таза, бедренная кость и кости грудной клетки, хотя СЮ может поражать любую кость.
Как правило, причиной обращения пациентов становится характерный для всех костных сарком болевой синдром и отек в области пораженной кости, а также лихорадка, потеря веса и утомляемость.
В анализах крови может быть выявлен лейкоцитоз, повышенный уровень ЛДГ.
ОСОБЕННОСТИ ЛЕЧЕНИЯ САРКОМЫ ЮИНГА
Лечение требует мультидисциплинарного комбинированного подхода, комбинация ХТ, операции и / или ЛТ позволяет достичь 5‑летней выживаемости, равной 75 %. Лечение практически всегда начинается с ХТ, независимо от того, локализованный это процесс или диссеминированный. Проводятся 4–6 курсов ХТ (табл. 5 и 7) каждые 2-3 недели с последующим этапом локального контроля (хирургическое лечение и / или ЛТ). Наиболее эффективной считаются альтернирующая комбинация циклофосфана, винкристина, доксорубицина, ифосфамида и этопозида (VAC / IE).
ЛУЧЕВАЯ ТЕРАПИЯ САРКОМЫ ЮИНГА
ЛТ – важный компонент лечения пациентов с СЮ. В зависимости от клинической ситуации возможно проведение консолидирующего, предоперационного или послеоперационного курсов дистанционной ЛТ области первичного очага, также возможно проведение ЛТ по поводу отдаленных метастазов.
Проведение консолидирующего курса дистанционной ЛТ показано при невозможности проведения радикального хирургического лечения. Облучение следует начать на 12–18 неделе ХТ. ЛТ проводится в РОД 2 Гр, СОД 44 Гр на область первичной опухоли до начала проведения лекарственного лечения (максимальный размер опухоли по первичной МРТ) с включением в объем облучения 1-1.5 см окружающих тканей, СОД 54 Гр на область первичной опухоли после проведения лекарственного лечения (определяется по МРТ, выполненному перед ЛТ) с включением в объем облучения 1-1.5 см окружающих тканей.
Проведение предоперационного курса дистанционной ЛТ рекомендуется при высокой вероятности R1 или R2 резекции. ЛТ проводится в режиме стандартного фракционирования с РОД 2 Гр, СОД 44 Гр на область исходного распространения опухоли до проведения лекарственного лечения (максимальный размер опухоли по МРТ) с включением в объем облучения 2 см окружающих тканей.
Послеоперационный курс дистанционной ЛТ нужно начать в срок не позднее 60 дней после операции:
- При R0 резекции облучение поводится в случае неполного патоморфологического ответа. ЛТ в режиме стандартного фракционирования в РОД 2 Гр, СОД 44 Гр на область исходного распространения опухоли до проведения лекарственного лечения (максимальный размер опухоли по МРТ) с включением в объем облучения 1–1,5 см окружающих тканей.
- При R1 резекции объем облучения, РОД и СОД такие же.
- При R2 резекции следует дополнительно эскалировать СОД на область остаточной опухоли и окружающие ткани в пределах 1–1,5 см до 54 Гр.
При метастатическом поражении легких, в случае достижения полного клинического ответа, возможно рассмотреть вариант облучения всего объема легких. Облучение проводится в режиме РОД 1,5 Гр до СОД 18 Гр.
ЛЕЧЕНИЕ РЕЦИДИВА/ПРОГРЕССИРОВАНИЯ САРКОМЫ ЮИНГА
При позднем прогрессировании заболевания возможно возобновление применявшихся ранее схем ХТ (например, VAC/IE, если не достигнута максимально допустимая кумулятивная доза доксорубицина). При раннем прогрессировании целесообразно применение схем второй и последующих линий ХТ. К ним относят комбинации темозоломида с иринотеканом ± винкристин и комбинацию гемцитабина с доцетакселом.
В единственном рандомизированном исследовании III фазы при рефрактерной и/или рецидивной саркоме Юинга показана эффективность высокодозного ифосфамида по сравнению с комбинацией циклофосфамида и топотекана, при этом введение высокодозного ифосфамида требует адекватной функции почек с учетом предлеченности пациентов. При последующем прогрессировании возможно назначение ингибиторов тирозинкиназ, в том числе кабозантиниба. В одноцентровом исследовании II фазы у пациентов с диссеминированной ОССЮ частичный ответ был достигнут в 25% случаев.
Выполнение радикальной операции является оптимальным вариантом локального контроля. Приоритетом является выполнение органосохраняющих операций. Операбельным является процесс, при котором выполнимо радикальное удаление опухоли, что гарантирует отсутствие местного рецидива. В специализированных центрах органосохраняющие операции выполняются у 80 % пациентов.
При первично резектабельной опухоли, а также в случаях, когда первично нерезектабельная опухоль стала резектабельной после 4–6 курсов индукционной ХТ, производится хирургическое лечение. При поражении ребер, диафизарных локализациях, протяженных поражениях по костномозговому каналу стабилизации в результате лекарственной терапии выполняется экстирпация кости. Зона предшествующей биопсии обязательно включается в блок удаляемых тканей!
При исходном поражении регионарных лимфатических узлов выполняется регионарная лимфаденэктомия.
При полной или значительной клинической регрессии опухоли в результате индукционной ХТ, особенно при сложных локализациях (позвоночник, кости таза), альтернативой хирургическому вмешательству может быть ЛТ. При невозможности выполнения органосохраняющих операций, сложной анатомической локализации или в случае нерадикальной операции целесообразно рассмотреть возможность проведения ЛТ.
После этапа локального контроля возобновляется проведение адъювантной или лечебной ХТ; проводится от 6 до 10 курсов ХТ в зависимости от эффективности предоперационного лечения.
Хорошим лечебным патоморфозом является определение менее 10 % жизнеспособных опухолевых клеток, в этом случае после операции проводится ХТ по той же схеме. При метастатическом поражении легких выполнение метастазэктомии или проведение ЛТ метастазов в легкие увеличивает выживаемость пациентов.
Пожалуй, самым значимым по своему содержанию и смыслу в 2022г было исследование III фазы по оценке эффективности топотекана/циклофосфамида и высоких доз ифосфамида у пациентов с рецидивной или первичной рефрактерной саркомой Юинга (rEEcur), которое является первым в истории рандомизированным контролируемым исследованием второй линии при саркоме Юинга (СЮ).
Пятилетняя общая выживаемость для первично-локализованной СЮ в возрасте <20 лет составляет 70-75%.
У пациентов с рецидивом заболевания при неэффективности стандартной терапии прогноз значительно хуже. До получения результатов исследования rEECur у нас было очень мало данных для выбора тактики лечения таких пациентов. Из четырех изученных схем либо проспективных исследований II фазы не было вообще (иринотекан/темозоламид), либо исследование было с небольшим набором пациентов, где сообщалось только о частоте объективного ответа (ЧОО).
Чтобы провести рандомизированное исследование редкого заболевания, авторы сформировали группу, в которую вошли 13 европейских стран, Новая Зеландия и Австралия, а также более 15 организаций, включая исследовательские консорциумы, научные центры, национальные и пациентские организации. Такое международное сотрудничество неминуемо связано с длительным периодом подготовки, где для планирования, финансирования и старта исследования требуется несколько лет, для завершения необходима максимально возможная отдача. К решению этой задачи авторы подошли несколькими способами.
Был выбран байесовский дизайн исследования с включением 4 групп, что позволило изучить различные схемы лечения. Исследование, в общем, состояло из II и III фазы, первичной конечной точкой для II фазы была ЧОО, а для III фазы – бессобытийная выживаемость (БСВ). На основе выбранной первичной конечной точки во II фазе и методом «исключая лишнего» в итоге в III фазе оставались всего две схемы. Это было сделано для того, чтобы можно было быстро перейти к III фазе, сравнив два лучших режима.
У такого подхода есть очевидный минус – существует вероятность того, что режим, исключенный во время II фазы, может оказаться столь же эффективным, как и один из окончательных режимов в III фазе: если ЧОО не является хорошим суррогатом БСВ, то исключенный рукав может быть лучше, чем оставшийся.
Еще одна уникальность исследования заключалась в том, что рандомизации между всеми четырьмя группами не требовалось. Пациенты и врачи, участвующие в исследовании, должны были согласиться только на рандомизацию в две или более группы испытаний. Приемлемые схемы сообщались после регистрации, но до рандомизации. Такой подход был использован для максимального увеличения числа пациентов с редким заболеванием, поскольку предполагалось несколько проблем. Некоторые схемы могут быть недоступны в определенных странах, пациент может не соответствовать критериям включения в одну из конкретных групп (схем) лечения или пациент или врач могут отказаться от конкретной группы (схемы) лечения.
Так, в группу с ифосфамидом было набрано всего 78 пациентов, хотя набор был открыт до апреля 2022 г., а в группу с топотеканом/циклофосфамидом – 162, в то время как в исключенных группах с гемцитабином/доцетакселом и иринотеканом/ темозоламидом было набрано 72 и 127 пациентов, соответственно. Причина заключается в том, что большее количество и исследователей, и пациентов отказывались на этапе до рандомизации от лечения в группе с ифосфамидом. Это связано как с возможностью центров провести данный режим, так и с опасениями докторов и пациентов по поводу возможного большего риска нежелательных явлений выбранной схемы.
Это вносит определенные опасения, что пациенты, рандомизированные в группу ифосфамида, могут отличаться от пациентов, рандомизированных в другие группы.
Прежде чем начать исследование, авторы провели несколько симуляций, смоделированных с разной годовой БСВ от 20% до 40%. Причины такого диапазона в БСВ заключаются в том, что до настоящего исследования данные о БСВ для этих схем проспективно не были достаточно описаны…
Первоначально авторы приняли решение отказаться от первых двух групп после того, как 50 пациентов были набраны во все группы (2018 г.), и от второй группы после того, как в них были набраны 75 пациентов (2020 г.), основываясь на первичной конечной точке для II фазы. Планировалось включение до 200 случаев в два конечных рукава, но с учетом полученных результатов комитет по контролю данных настоял на закрытии набора и публикации данных.
Что касается общих характеристик (время появления рецидива/прогрессирования, распространенность заболевания) для всех 439 рандомизированных случаев, то у 85% пациентов был первый эпизод прогрессирования: 52% – менее двух лет после завершения первичного лечения, 18% – первичная рефрактерность, 15% – рецидив через 2 и более лет. У большинства (85%) пациентов было метастатическое заболевание (33% – метастазы в легкие). Каждый рукав был сбалансирован по этим характеристикам и пропорционально существенно не отличался от общей когорты.
Медиана БСВ в группе топотекана/ циклофосфамида составила 3,5 месяца (95% ДИ 2,1-5,1) и 5,7 месяца (95% ДИ 3,8-6,9) в группе ифосфамида, что соответствует 10% разнице в 6-месячной выживаемости между группами (37% и 47% соответственно). Вероятность того, что БСВ при ифосфамиде лучше, чем при топотекане/ циклофосфамиде, составляет 96% (HR=0,73; 95% ДИ 0,51-1,05). Вторичная конечная точка была также достигнута, медиана общей выживаемости (мОВ) составила 10,5 месяца (95% ДИ 7,2-15,0) и 15,4 месяца (95% ДИ 11,3-20,9) для топотекана/циклофосфамида и ифосфамида соответственно.
Помимо пятимесячной разницы между группами в медиане ОВ, одногодичная разница ОВ составила 10%. Вероятность того, что ОВ при IFOS лучше, чем при TC, составляет 94% (HR=0,73; 95% ДИ 0,50-1,08). При анализе подгрупп в соответствии с возрастом (≤14 и >14 лет) было отмечено, что группа ифосфамида была равноэффективной в обеих группах по сравнению с топотеканом/циклофосфамидом, но наблюдалась очевидная разница для детей (≤14 лет). Также у детей в группе ифосфамида отмечались более высокие показатели качества жизни по сравнению с топотеканом/циклофосфамидом, в отличие от подростков или взрослых.
Что касается оценки безопасности, то для 146 пациентов, включенных в III фазу сравнения, ифосфамид с большей вероятностью вызывал токсичность 3-й степени.
Частота фебрильной нейтропении была одинаковой в двух группах, но у пациентов, получающих ифосфамид, чаще встречались инфекции 3 степени. Характерные для высокодозного ифосфамида нежелательные явления (НЯ) ожидаемо встречались чаще, чем в группе топотекана/циклофосфамида: случай энцефалопатии 3 степени (8%) или нарушение функции почек (8%).
Если посмотреть на причину выхода из КИ, то в 53% случаев в группе топотекана/циклофосфамида – это прогрессирование, а в группе ифосфамида 22% – прогрессирование и 26% – вследствие НЯ.
Но! В группе топотекана/циклофосфамида возможно было снижение доз и продолжение участия в КИ, тогда как в группе с ифосфамидом – нет.
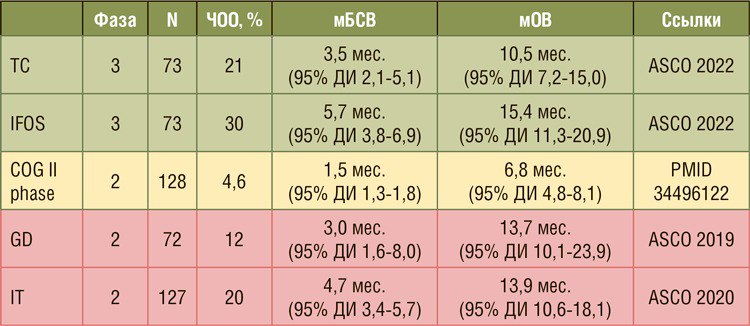
Сравнивая полученные данные с историческим эталоном (исследование COG II фазы), где медиана БСВ и медиана ОВ для данных пациентов была 1,5 и 6,8 месяца соответственно, были получены лучшие результаты в обоих исследуемых рукавах.
Результаты в исключенных рукавах были представлены на предыдущих конференциях ASCO – 2019 и 2020 гг. (таблица). И в свете полученных результатов их так же важно оценить.
В то время как ЧОО для гемцитабина/доцетаксела составляет менее 20%, как гемцитабин/доцетаксел, так и иринотекан/темозоломид имеют лучшую медиану БСВ и ОВ, чем исторический контроль (исследование COG II фазы).
В случае иринотекана/темозоломида медиана БСВ приближается к наблюдаемой при высоких дозах ифосфамида.
В настоящее время, ввиду особенностей набора пациентов при рандомизации, сказать однозначно, что исключенные режимы хуже, чем высокодозный ифосфамид, невозможно. Поэтому они остаются разумными опциями при выборе схемы лечения рефрактерной/рецидивной саркомы Юинга.
Чем это исследование примечательно? Это первое рандомизированное исследование эффективности и безопасности ХТ при рефрактерной и рецидивной саркоме Юинга. Дизайн исследования помог быстро достичь его контрольных точек. Мы увидели, что схема с высокодозным ифосфомидом лучше, чем комбинация топотекана/циклофосфамида, особенно у детей.
Но у нас остались другие режимы, которые непосредственно применяются в реальной клинической практике, а именно комбинация иринотекана/ темозоломида во вторую линию и гемцитабина/доцетаксела в последующую.
J Clin Oncol. 2022; 40 (suppl 17; abstr LBA2).
Collier AB 3rd, et al. Pediatr Blood Cancer. 2021 Dec; 68(12): e29333.
САРКОМА ЮИНГА. ПЕРСПЕКТИВЫ
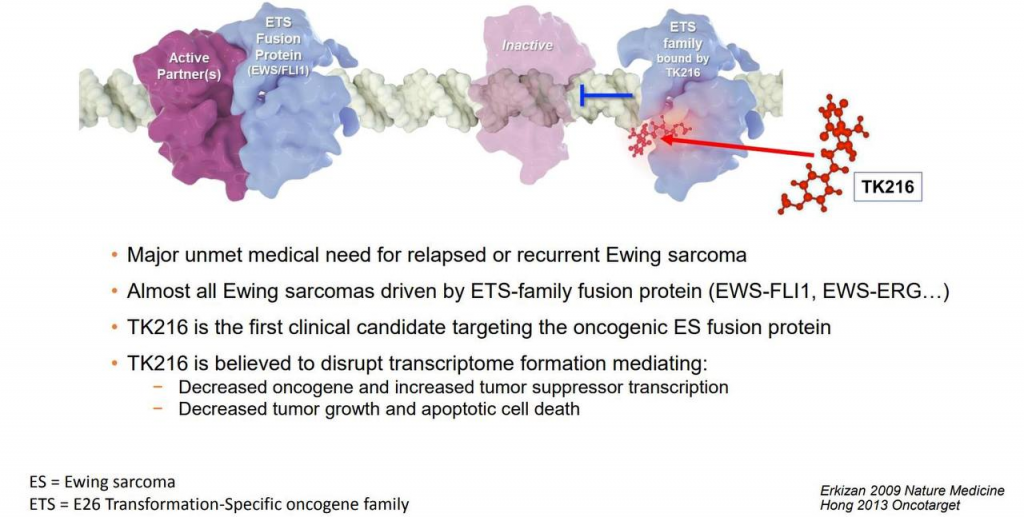
Классическое комбинированное лечение позволяет снизить опухолевую нагрузку, однако не уничтожает остаточные опухолевые клетки, а появление новых препаратов до сих пор не привело к улучшению ситуации. Для элиминации дремлющих и химиорезистентных клеток необходимы новые методы лечения с иным механизмом действия, нежели классическая химиотерапия, и одним из таких вариантов является применение TK216.
В исследовании I фазы оценивалась эффективность TK216, нового анти-ETS препарата в лечении саркомы Юинга. Химерные онкопротеины, кодируемые слиянием гена EWS и одного из пяти различных факторов транскрипции ETS, являются доминирующими факторами развития заболевания. TK216 был разработан для прямого связывания белков ETS, нарушения взаимодействия белков и ингибирования функции фактора транскрипции и, соответственно, причины апоптической гибели клеток.
В данном исследовании взрослым пациентам и детям с прогрессирующей или рефрактерной саркомой Юинга препарат TK216 вводили путем непрерывной внутривенной инфузии, исследование было создано по дизайну 3 + 3.
Продолжительность введения составляла 7 дней, позже была увеличена до 10 и 14 дней, перерыв между непрерывными инфузиями составил 14 дней.
Дозолимитирующую токсичность оценивали во время первого цикла, а эффективность после завершения второго цикла. Винкристин мог быть добавлен к лечению после второго цикла. Было включено 32 пациента в 9 когорт по эскалации дозы TK216 в диапазоне от 18 до 288 мг/м2/сут. Максимально переносимая доза для 14-дневной инфузии составляла 200 мг/м2/сут, что было выбрано в качестве рекомендуемой дозы исследования II фазы. На лечение влияла дозолимитирующая токсичность в виде нейтропении/фебрильной нейтропении и других нежелательных явлений (тромбоцитопения, анемия и астения). 9 пациентов получили максимально переносимую дозу ТК216 в комбинации с винкристином. Никаких новых нежелательных явлений отмечено не было, за исключением нейротоксичности, ассоциированной с винкристином.
По состоянию на 11 мая 2020 года наблюдалась следующая эффективность: частичный эффект 18% (2/11), стабилизация заболевания 45% (5/11), частота общей клинической эффективности составила 64% (7/11). У 3 пациентов еще до выполнения первой оценки эффективности было зарегистрировано прогрессирование заболевания, всего прогрессирование заболевания зарегистрировано в 36% (4/11). Примечательны два клинических ответа. У одного пациента зарегистрирован частичный эффект с регрессией всех контрольных очагов в легких после двух циклов только с ТК216.
После 6 месяцев терапии TK216 +/- Винкристин было выполнено удаление небольшого остаточного поражения для достижения хирургического полного эффекта, далее пациент получал лечение в течение более чем 14 месяцев. У второго пациента частичный эффект представлен в виде 90% уменьшения всех контрольных очагов в легких согласно RECIST 1.1 после двух циклов ТК216 + винкристин.
Таким образом, TK216 продемонстрировал хорошую переносимость и ранние доказательства противоопухолевой активности в популяции пациентов с саркомой Юинга и ограниченными вариантами лечения или без них, и мы ожидаем дальнейшее изучение эффективности препарата.
Annals of Oncology.
Volume 31, Supplement 4, September 01, 2020; S972. DOI:
https://doi.org/10.1016/j.annonc.2020.08.1846


Комментарии (0)