Хондросаркома занимает второе место среди первичных злокачественных опухолей костей по встречаемости и составляет по различным данным от 20 до 27% всех первичных сарком костей. Наиболее часто опухоль локализуется в бедренной кости, костях таза, плечевой кости, ребрах, грудине, лопатке. Пик частоты заболевания приходится на возраст после 50 лет, но хондросаркома может встречаться в возрасте от 5 до 85 лет и почти одинаково часто наблюдается как у мужчин, так и у женщин. Хондросаркома делится на первичную (90%) и вторичную хондросаркому, возникающую на фоне предсуществующих процессов (например болезнь Олье, синдром Мафуччи). Конвециональная (классическая) форма хондросаркомы составляет около 90% всех случаев; 10-15% всех хондросарком составляют следующие подтипы: светлоклеточная, юкстакортикальная, дедифференцированная, миксоидная и мезенхимальная хондросаркома. Очень редко встречаются экстраскелетные хондросаркомы.
Клинические проявления при хондросаркоме не имеют своей специфичности и, как правило, проявляются болевым синдромом при той или иной локализации. Как правило, боли носят медленно нарастающий длительный характер. Основными факторами прогноза при классической хондросаркоме являются степень дифференцировки опухоли, ее размер и возможность радикального хирургического лечения. Общая 5-летная и 10-летная выживаемости при классической хондросаркоме достаточно благоприятные. Редкие подтипы – мезенхимальная и дедифференцированная хондросаркомы, отличаются значительно более неблагоприятным прогнозом. Значительно проще определиться с тактикой лечения, если это хондросаркома G1...но действительно ли это клачисеская ХС G1? И что делать при поражении осевого скелета, или если есть отсевы, даже при G1-G2? И уж тем более, как быть, если речь идет о дедифференцированной или мезенхимальной ХС?
Cтепень злокачественности является одним из наиболее важных показателей клинического поведения и прогноза классической хондросаркомы. Она оценивается в градации (Grade, G) от 1 до 3 в зависимости от размера ядра, степени окрашивания (гиперхромазия), клеточности и митотической активности.
АТИПИЧНАЯ ХРЯЩЕВАЯ ОПУХОЛЬ И/ИЛИ ХОНДРОСАРКОМА G1?
Термин «атипичная хрящевая опухоль» был введен в систему классификации Всемирной организации здравоохранения (ВОЗ) в 2013 г. для более точного определения клинического поведения хорошо дифференцированных/высокодифференцированных поражений, ранее называемых «хондросаркомой G1», которые, особенно в длинных костях, ведут себя локально агрессивно, но не метастазируют. Следовательно, их не следует классифицировать как опухоли, обладающие полноценным злокачественным потенциалом.
В следующем пересмотре классификации ВОЗ в 2020 г. эта категория опухолей и сама терминология несколько изменилась с учетом различий в биологическом поведении в зависимости от локализации этой опухоли... Термин «атипичная хрящевая опухоль» используется для описания опухолей аппендикулярного скелета (длинные и короткие трубчатые кости), тогда как «хондросаркома G1» может использоваться для опухолей осевого скелета, включая таз, лопатку и основание черепа (плоские кости). Эти опухоли умеренно клеточные, с обильным гиалиновым хрящевым матриксом. Хондроциты имеют маленькие круглые ядра и иногда двуядерные. Митозы отсутствуют. Атипичная хрящевая опухоль / хондросаркома G1 почти никогда не метастазирует (риск составляет около 1%). Десятилетняя выживаемость для данных пациентов составляет от 83 до 95%.
ХОНДРОСАРКОМЫ G2
Хондросаркомы G2 являются более клеточными с меньшим количеством хондроидного матрикса, чем атипичная хрящевая опухоль / хондросаркома G1. Митозы присутствуют, но широко рассеяны. Ядра хондроцитов увеличены и могут быть как везикулярными, так и гиперхромными. Метастатический потенциал является промежуточным между хондросаркомами низкой и высокой степени злокачественности (приблизительно 10–15%). Десятилетняя выживаемость составляет примерно от 64 до 86%.
Подавляющее большинство классический (первичных и вторичных) хондросарком представляют собой атипичную хрящевую опухоль / хондросаркома G1 или хондросаркому G2.
ХОНДРОСАРКОМЫ G3
Хондросаркомы G3 являются низкоклеточными, с ядерным плеоморфизмом и легко выявляемыми митозами, а также с характерными изменениями веретенообразных клеток по периферии опухолевых узлов. Хондроидный матрикс разрежен или отсутствует. Хондросаркомы низкой степени злокачественности имеют высокий метастатический потенциал (примерно от 32 до 70%). 10-летняя выживаемость составляет примерно от 29 до 55%.
В большинстве случаев степень дифференцировки рецидивирующей хондросаркомы такая же, как и при первичном поражении, однако до 13% рецидивов имеют более высокую (худшую) степень злокачественности по сравнению с исходным поражением. Это говорит о том, что хондросаркомы могут прогрессировать биологически по своей структуре, т.е. дедифференцироваться.
Кроме того, хондросаркомы, расположенные в осевом скелете, имеют худший прогноз и требуют более агрессивного лечения.
ДОБРОКАЧЕСТВЕННЫЕ ПОРАЖЕНИЯ, КОТОРЫЕ МОГУТ ПРЕДШЕСТВОВАТЬ ХОНДРОСАРКОМЕ
ОСТЕОХОНДРОМА (остеохрящевой экзостоз) представляет собой костный выступ, покрытый хрящом, возникающий на внешней поверхности кости, в полости содержит костный мозг, который является продолжением подлежащей кости. Большинство из них расположены в длинных костях, преимущественно вокруг колена.
Наследственные множественные остеохондромы (наследственные множественные экзостозы) характеризуется развитием двух и более остеохондром в аппендикулярном и осевом скелете. Этот синдром наследуется по аутосомно-доминантному типу. Распространенность в общей популяции составляет 1:50 000, мужчины болеют несколько чаще, чем женщины.
Почти 90% случаев множественных остеохондром вызваны наследованием зародышевой мутации в одном из генов-супрессоров опухолей EXT1 или EXT2.
Хотя большинство из них протекают бессимптомно, остеохондромы могут вызывать боль, функциональные осложнения и деформации, а также риск перелома. По имеющимся оценкам, злокачественная трансформация происходит у 5% пациентов с солитарными или множественными остеохондромами. В одной серии клинических случаев среднее время между постановкой диагноза и злокачественной трансформацией составило 9,8 лет. Все хондросаркомы, возникающие на фоне остеохондромы, являются вторичными периферическими опухолями.
Изменение размера остеохондромы или появление новых симптомов требует изучения и обследования, так как каждое из них может предвещать прогрессирование в злокачественное новообразование. Имеются данные, что остеохондромы, расположенные в области таза, бедер и плечевого пояса, особенно склонны к злокачественной трансформации. Среди пациентов с множественными остеохондромами злокачественная трансформация, по-видимому, не связана с наличием или отсутствием мутации EXT, полом, тяжестью заболевания или количеством поражений.
ДОБРОКАЧЕСТВЕННЫЕ ПОРАЖЕНИЯ, КОТОРЫЕ МОГУТ ПРЕДШЕСТВОВАТЬ ХОНДРОСАРКОМЕ
ЭНХОНДРОМА
Энхондромы — распространенные доброкачественные хрящевые опухоли, которые развиваются в мозговом веществе кости. Когда присутствуют множественные энхондромы, вызывающие деформацию, это состояние называется энхондроматозом, из которых наиболее распространенной формой является болезнь Олье (оценочная распространенность 1 на 100 000). Когда множественные энхондромы связаны с гемангиомами мягких тканей, особенно гемангиомой веретенообразных клеток, это называется синдромом Маффуччи. Оба являются врожденными, но не наследстенными.
Болезнь Олье, а также синдром Маффуччи вызываются соматическими мозаичными мутациями в генах IDH1 или IDH2.
Хотя подавляющее большинство из них протекает бессимптомно, клинические проблемы, вызванные энхондромами, включают деформацию скелета, несоответствие длины конечностей и риск злокачественной трансформации. Злокачественная трансформация солитарной энхондромы считается чрезвычайно редкой (<1%), но была описана. Риск хондросаркомы при болезни Олье или синдроме Маффуччи достигает 50%. Риск наиболее высок при энхондромах, расположенных в области таза. Злокачественная трансформация обычно проявляется после созревания скелета и предвестником может быть развитие боли.
Гистологическое и рентгенографическое различие между энхондромой и атипичной хрящевой опухолью/хондросаркомой grade 1 (ACT/CS1) может быть затруднено даже в опытных руках.
НАИБОЛЕЕ ЧАСТЫЕ ТИПЫ ХОНДРОСАРКОМ
Здесь мы перечислим основные особенностей, мне очень нравится сравнительная таблица, которая кратко объясняет отличия всех подтипов ХС
Классическая (центральная) хондросаркома. Составляют примерно 75% от всех хондросарком. Считается, что большинство из них возникает первично (т. е. без доброкачественного предшествующего поражения). Однако обнаружение остатков ранее существовавшей энхондромы примерно в 40% центральных хондросарком и тот факт, что большинство энхондром клинически бессимптомны, наводит на гипотезу о том, что большинство классических хондросарком могут быть вторичными по отношению к ранее существовавшей энхондроме.
Хондросаркомы таза отличаются худшей общей выживаемостью по сравнению с другими локализациями за счет быстрого роста опухоли, экстракомпартментарное распространение и появления метастазов.
Вторичная периферическая хондросаркома. По определению, все периферические хондросаркомы возникают в пределах хрящевого покрова ранее существовавшей остеохондромы. Различие между остеохондромой и вторичной периферической атипичной хрящевой опухолью/хондросаркомой G1, возникающей при остеохондроме, может быть затруднено и должно определяться мультидисциплинарной саркомной командой специалистов. Размер хрящевой шапочки является наиболее важным параметром и должен измеряться перпендикулярно. Размер хрящевой шапочки >2 см у взрослых указывает на прогрессирование заболевания.
Периостальная хондросаркома. Менее 1% хондросарком возникают на поверхности кости и называются периостальными (ранее называвшимися юкстакортикальными) хондросаркомами. При выполнении адекватного и радикального объема операции прогноз при периостальной хондросаркоме благоприятный, несмотря на наличие компонента с низкой дифференцировкой. Поэтому гистологическая градация в этом подтипе не используется.
Гистологические особенности наиболее частых подтипов ХС — при малом увеличении наблюдается обильная продукция хрящевого матрикса, а дольки хряща неправильной формы, часто разделенные фиброзными тяжами, могут проникать в костные трабекулы. Некроз или митозы могут наблюдаться при G3. Гистология периостальных хондросарком аналогична.
Гистологическое (и рентгенологическое) различие между доброкачественным поражением хряща и атипичной хрящевой опухолью/хондросаркомой G1 может быть чрезвычайно трудным. Атипичная хрящевая опухоль/хондросаркома G1 является гиперклеточной по сравнению с доброкачественными поражениями хряща. Хондроциты кажутся слегка или умеренно атипичными и содержат увеличенные гиперхроматические ядрышки. Проникновение/врастание в ранее кость и изменения мукомиксоидного матрикса являются важными характеристиками, которые можно использовать для дифференцировки АХО/ХС G1 от энхондромы. Периостальная хондросаркома отличается от периостальной хондромы по размеру (≥5 см) и/или наличию кортикальной инвазии. Для энхондром фаланг допустимо наличие злокачественных гистологических признаков, а диагноз хондросаркомы в этой локализации основывается на наличии деструкции кортикального слоя, инвазии в мягкие тканм и митозов.
К счастью, различие между энхондромой и АХО/ХС G1 не всегда важно для принятия решения, поскольку тактика лечения для них (операция – в объеме экскохлеации опухоли) одинакова.
СРАВНИТЕЛЬНАЯ ТАБЛИЦА ПО ПОДТИПАМ ХОНДРОСАРКОМЫ
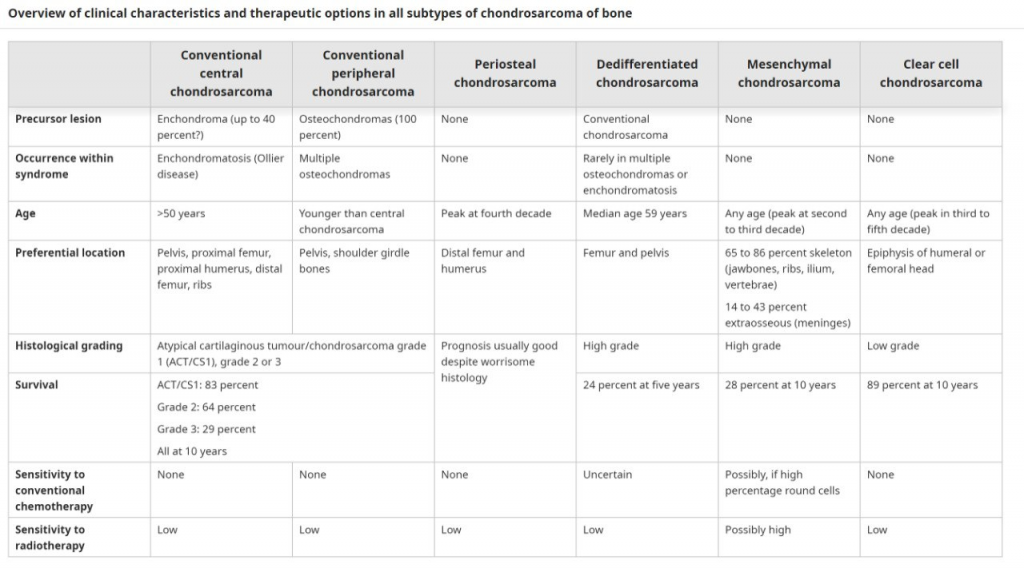
РЕДКИЕ ПОДТИПЫ ХОНДРОСАРКОМЫ
Существует несколько редких подтипов, которые вместе составляют менее 10% от всех хондросарком.
Дедифференцированная хондросаркома. Дедифференцированные хондросаркомы считаются крайне редкими костными саркомами, они содержит два смежных компонента: высокодифференцированную хрящевую опухоль (которая может быть либо энхондромой, либо хондросаркомой низкой степени злокачественности) и бесхрящевую саркому высокой степени злокачественности, которая чаще всего представляет собой остеосаркому, фибросаркому или недифференцированную плеоморфную саркому (ранее называвшаяся злокачественной фиброзной гистиоцитомой).
Оба компонента, по-видимому, имеют некоторые общие генетические аберрации с дополнительными генетическими изменениями в низкодифференцированном компоненте. Это предполагает наличие общей клетки-предшественника с ранней дивергенцией двух компонентов. Более 50% дедифференцированных хондросарком содержат мутации в IDH1 или IDH2, часто в сочетании с мутацией в промоторе TERT, TP53, CDKN2A/B или других. Мутации IDH обнаруживаются в обоих компонентах, что подтверждает общее происхождение обоих компонентов.
Дедифференцированные хондросаркомы очень агрессивны и имеют плохой прогноз. В многоцентровом обзоре 337 случаев с данным диагнозом в 21% были метастазы на момент постановки диагноза; 2ух лётная выживаемость у данных пациентов составила 10%. Даже у пациентов без метастазов на момент постановки диагноза 10летная выживаемость составила всего 28%. Неблагоприятные прогностические факторы включают патологический перелом, расположение опухоли в тазу и пожилой возраст.
Мезенхимальная хондросаркома. Этот ультраредкий тип саркомы характеризуется дифференцированным хрящом, смешанным с солидными участками, состоящими из недифференцированных мелких круглых клеток. Существует высокая доля экстраскелетных первичных опухолей, чего не наблюдается при других подтипах хондросаркомы. Кроме того, в отличие от обычных хондросарком, мезенхимальные чаще всего поражают осевой скелет, включая черепно-лицевые кости (особенно челюсть), ребра, подвздошную кость и позвонки, также в процесс могут быть вовлечены несколько костей. Приблизительно в 20% случаев имеются метастазы при постановке диагноза.
Мезенхимальные хондросаркомы имеют тенденцию к локальным и отдаленным рецидивам, которые могут возникать в течение 20 лет после первоначальной постановки. Прогноз заметно хуже, чем при обычных первичных хондросаркомах. Зарегистрированные показатели 10-летней выживаемости колеблются от 10 до 54%.
Светлоклеточная хондросаркома. Данный подиип представляет собой ультраредкий вариант хондросаркомы низкой степени злокачественности, который характеризуется наличием дольчатых групп опухолевых клеток без выпуклостей с крупными центрально расположенными ядрами и прозрачной пустой цитоплазмой в дополнение к гиалиновому хрящу. Митотические фигуры встречаются редко. Многие опухоли содержат зоны обычной хондросаркомы с гиалиновым хрящом и минимально атипичными ядрами.
Несмотря на степень злокачественности, краевая резекция или экскохлеация связаны с частотой рецидивов в 70% и более, и такой объем операции следует избегать. В случаях неполного удаления могут развиваться метастазы, обычно в легкие и другие отделы скелета, а общая выж выживаемость составляет до 15%. Напротив, широкое удаление единым блоком обычно приводит к излечению. Рецидив заболевания может произойти спустя 24 года после постановки диагноза, поэтому обязательно длительное наблюдение.
Миксоидная хондросаркома. В настоящее время общепризнано, что миксоидная хондросаркома кости представляет собой обычную хондросаркому высокой степени злокачественности с выраженными миксоидными изменениями и не связана с внескелетной миксоидной хондросаркомой (EMC), саркомой мягких тканей, которая чаще всего возникает в нижних конечностях.
Миксоидные хондросаркомы следует рассматривать как миксоидный вариант классический хондросаркомы средней или высокой степени злокачественности.
МОЛЕКУЛЯРНЫЙ ПАТОГЕНЕЗ
Хрящевые опухоли почти всегда обнаруживаются в костях, возникающих в результате энхондральной оссификации. Существуют некоторые параллели между ростом и дифференцировкой хондроцитов в нормальной пластинке роста как доброкачественных, так и злокачественных хрящевых опухолей.
В пределах нормальной зоны роста хондроциты зоны покоя пролиферируют и дифференцируются, становясь гипертрофированными. Эти клетки подвергаются апоптозу, что позволяет инвазировать сосуды и остеобласты, которые начинают формировать кость и приводят к продольному росту кости. Этот физиологический процесс жестко регулируется компонентами сигнального пути белка Indian hedgehog (IHH) / паратиреоидного гормона (PTHRP).
Пациенты с множественными остеохондромами (ранее называвшимися наследственными множественными экзостозами) имеют герминальные мутации в генах экзостозина (EXT1 или EXT2) с потерей оставшегося аллеля дикого типа в хрящевой шапке остеохондромы. Конечным результатом является уменьшение экспрессии EXT. Потеря экспрессии генов EXT из-за гомозиготной делеции EXT1 также наблюдается при солитарных остеохондромах, не связанных с наследственным синдромом. Продукты гена EXT участвуют в биосинтезе гепарансульфатных протеогликанов (HSPG), которые необходимы для передачи сигналов клетками через IHH/PTHLH и другими путями.
В остеохондромах, где EXT инактивирован, HSPG, по-видимому, накапливаются в цитоплазме и аппарате Гольджи вместо того, чтобы транспортироваться на клеточную поверхность. Это препятствует множественным сигнальным путям роста (включая пути белков IHH/PTHRP), которые, как отмечалось выше, важны для нормальной пролиферации и дифференцировки хондроцитов в пределах нормальной ростовой пластинки.
При вторичных периферических хондросаркомах, возникающих при остеохондромах, EXT обычно является диким типом, что позволяет предположить, что клетки дикого типа при остеохондроме склонны к злокачественной трансформации через независимые от EXT механизмы. Используя мышиную модель, было показано, что дополнительные генетические изменения, включающие путь TP53 или pRb, участвуют в прогрессировании от остеохондромы до вторичной периферической хондросаркомы. Кроме того, предполагается роль передачи сигналов IHH, хотя данные не совсем согласуются:
● Передача сигналов PTHRP, которая находится ниже IHH и участвует в пролиферации хондроцитов, отсутствует при остеохондромах, но активируется при злокачественной трансформации в сторону вторичной периферической хондросаркомы, особенно при поражениях высокой степени злокачественности.
● Существует сниженная экспрессия нижестоящих мишеней в сигнальном каскаде IHH во время прогрессии опухоли при периферических хондросаркомах, в то время как они все еще активны при центральных хондросаркомах.
● Данные моделей in vitro и in vivo показывают, что обработка клеток центральной хондросаркомы рекомбинантным hedgehog увеличивает пролиферацию, тогда как обработка ингибиторами передачи сигналов hedgehog ингибирует пролиферацию и рост опухоли в небольшой подгруппе опухолей и клеточных культур хондросаркомы. Кроме того, дефектная передача сигналов hedgehog также влияет на передачу сигналов костного морфогенетического белка.
МОЛЕКУЛЯРНЫЕ ОСОБЕННОСТИ
С помощью NGS были определены различные молекулярные изменения, некоторые из которых связаны с отдельными подтипами хондросаркомы.
Среди энхондром и первичных (центральных) хондросарком точечные мутации в генах изоцитратдегидрогеназы-1 и изоцитратдегидрогеназы 2 (IDH1 и IDH2) были идентифицированы в 40–56% случаев. Кроме того, болезнь Олье и синдром Маффуччи вызываются соматическими мозаичными мутациями в IDH1 и IDH2. Изоцитратдегидрогеназа представляет собой фермент, который превращает изоцитрат в альфа-кетоглутарат в цикле трикарбоновых кислот. Мутации в IDH1 и IDH2 вызывают повышение уровня онкометаболита D-2-гидроксиглутарата (D-2-HG), который конкурентно ингибирует ферменты, зависимые от альфа-кетоглутарата, такие как TET2, тем самым индуцируя эпигенетические изменения, включая гиперметилирование ДНК и модификацию гистонов, вероятно влияющих на дифференцировку. Повышенные уровни D-2-HG способствуют хондрогенной и ингибируют остеогенную дифференцировку мезенхимальных стволовых клеток. Таким образом, мутации в IDH1 или -2 приводят к локальному блоку остеогенной дифференцировки во время скелетогенеза, вызывая развитие доброкачественных хрящевых опухолей. Эти данные подтверждают, что мутации в IDH являются ранним событием, связанным с развитием доброкачественных энхондром. В клеточных линиях хондросаркомы ингибирование мутантного IDH1, по-видимому, не влияет на онкогенные свойства, или только при очень высоких дозах или после длительного лечения. Данные о связи между мутацией IDH и прогнозами относительно выживаемости достаточно противоречивы.
IDH2-мутантные опухоли встречаются у пожилых пациентов и чаще у пациентов с высокозлокачественной или дедифференцированной хондросаркомой. Мутации TERT чаще всего встречаются в опухолях с мутацией IDH2, хотя они не влияют на выживаемость в этой группе. Напротив, мутации TERT реже встречаются в опухолях с мутацией IDH1, но они связаны с менее благоприятным исходом в этой группе.
Мутации TERT нечасты в опухолях дикого типа IDH, которые, как правило, диагностируются в более молодой популяции, чем хондросаркомы с мутацией IDH. Геномно для этой молекулярной подгруппы характерна гаплоидизация и последующее удвоение генома. Эти опухоли реже переходят в дедифференцированные опухоли и, следовательно, составляют группу более низкого риска.
Описано, что прогрессирование хондросаркомы связано с геном-супрессором опухоли CDKN2A (p16), расположенным в 9p21 и с изменениями в p53.
Мутации в COL2A1 и YEATS2 обнаружены в подмножестве хондросарком, значение которых неизвестно. Другие гены, о которых сообщается, что они периодически мутируют, включают ATRX и промотор TERT. Мутации в промоторе TERT связаны с прогрессированием заболевания.
Среди классических первичных хондросарком была описана активация и/или сверхэкспрессия рецепторов фактора роста тромбоцитов альфа (PDGFRA) и бета (PDGFRB), хотя активирующие мутации не были обнаружены. Терапевтическое значение этого открытия обсудим позже.
Дедифференцированные хондросаркомы также содержат мутации IDH1 или IDH2 примерно в 50% случаев, а также мутации промотора COL2A1 и TERT.
Было показано, что большинство мезенхимальных хондросарком содержат специфический продукт слияния HEY1-NCOA2, вызванный внутрихромосомной перестройкой плеча хромосомы 8q. В качестве альтернативы был описан слитый ген IRF2BP2-CDX1, вызванный транслокацией t(1;5)(q42;q32). Слитый белок HEY1-NCOA2 предпочтительно связывается с промоторными областями канонических мишеней HEY1, что приводит к трансактивации мишеней HEY1 и усилению клеточной пролиферации. Более того, PDGFRB и PDGFRA были непосредственно нацелены на слияние и повышали уровень фосфо-AKT (Ser473). В одном исследовании иматиниб уменьшал рост опухоли in vitro, а также в ксенотрансплантате, полученном от пациента.
Среди светлоклеточной хондросаркомы специфических рецидивирующих изменений выявлено не было.
Дефицит репарации и высокая мутационная нагрузка опухоли не характерны для хондросарком, как и для других сарком.
Доклинические модели показали, что иммунное микроокружение при хондросаркоме, преимущественно состоящее из лимфоцитов и макрофагов в перитуморальной области, способствует прогрессированию хондросаркомы. Более конкретно, с помощью углубленного анализа относительно небольшой серии хондросарком (n = 22) были определены три группы:
• Подтип I, «доминантный кластер супрессорных клеток гранулоцитарно-миелоидного происхождения (G-MDSC)» с большим количеством HLA-DR-отрицательных CD14-отрицательных миелоидных клеток; эти опухоли были мутантными по IDH и имели миксоидную морфологию.
• Подтип II, кластер «иммунного истощения», с высокой инфильтрацией истощенных Т-клеток и дендритных клеток; эти опухоли часто являются мутантными IDH и имеют высокую степень злокачественности.
• Подтип III, кластер «иммунной пустыни», с небольшим количеством иммунных клеток. Эти опухоли чаще всего низкозлокачественные и чаще IDH дикого типа.
ОСОБЕННОСТИ ЛЕЧЕНИЯ ХОНДРОСАРКОМ
Основным вариантом лечения является хирургическое радикальное удаление опухоли в пределах здоровых тканей, что является прогностически важным фактором. У пациентов с небольшими по размеру опухолями и степенью дифференцировки G1 в ряде случаев возможно выполнение экскохлеации опухоли с тщательной обработкой полости. Классическая хондросаркома отличается низкой чувствительностью к лекарственному лечению. Исключения составляют мезенхимальная и дедифференцированная хондросаркомы, отличающиеся неблагоприятным прогнозом. В отношении данных подтипов рекомендовано проведение тех же принципов лечения, как для ОССЮ и остеосаркомы соответственно.
ОСНОВНОЙ ПРИНЦИП ЛЕКАРСТВЕННОГО ЛЕЧЕНИЯ ХОНДРОСАРКОМ
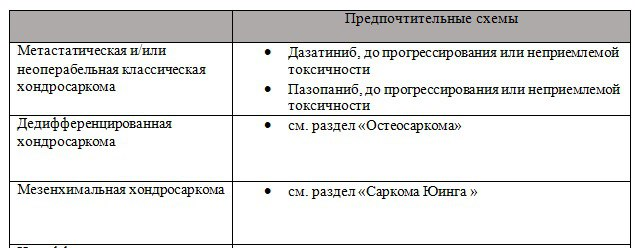
ЛУЧЕВАЯ ТЕРАПИЯ ПРИ ХОНДРОСАРКОМАХ
Предоперационный курс дистанционной ЛТ следует проводить в случае опухоли высокой степени злокачественности, распространяющейся за пределы костных структур и только при высоком риске положительных краев резекции. В объем облучения входит вся первичная опухоль. Облучение проводится в режиме стандартного фракционирования РОД 2 Гр до СОД 50 Гр. Послеоперационный курс дистанционной ЛТ проводится только при крае резекции R1 или R2. Показано облучение ложа удаленной опухоли в РОД 2 Гр до СОД 70 Гр при R1, возможна эскалация дозы до СОД 78 Гр при R2. При невозможности выполнения радикальной операции рекомендуется проведение курса дистанционной ЛТ области первичной опухоли РОД 2 Гр до СОД 70-78 Гр (в зависимости от толерантности окружающих тканей). Возможно рассмотреть варианты лечения неоперабельных опухолей при помощи стереотаксической ЛТ или радиохирургии, либо в лечебных учреждениях, располагающих протонной ЛТ.
ИССЛЕДУЕМЫЕ ОПЦИИ ЛЕКАРСТВЕННОГО ЛЕЧЕНИЯ
Открытие новых сигнальных путей в нескольких гистологических подтипах хондросаркомы вызвало интерес к молекулярно-направленной терапии, особенно для неоперабельных или метастатических хондросарком. В качестве примеров:
● Ингибиторы IDH. В I фазе исследования ивосидениб, селективный ингибитор мутантного фермента IDH1, показал активность у пациентов с распространенной хондросаркомой и с мутацией IDH1. В то время как доклинические исследования не показали эффективности ингибирования мутантного IDH1, другие подобные исследования продемонстрировали некоторую эффективность агентов, нацеленных на последующие эффекты мутации IDH. Примерами являются препараты, которые ингибируют NAMPT (например, ингибирование пути синтеза NAD); ингибиторы ферментной поли-АДФ-рибозо-полимеразы (PARP); и ингибиторы глутаминолиза (например, метформин, фенформин, хлорохин и ингибиторы глутаминазы). Клиническое исследование Ib фазы с метформином и хлорохином при солидных опухолях с мутацией IDH, включая хондросаркому, не продемонстрировало клинического ответа.
● Ингибиторы mTOR – мишень пути рапамицина (mTOR) активируется в большинстве клеточных линий хондросаркомы. Агенты, которые ингибируют путь mTOR (например, сиролимус), имеют ограниченную активность при хондросаркоме, основываясь на данных серии наблюдений и клинического исследования комбинации сиролимуса и циклофосфамида.
● Ингибиторы тирозинкиназы – рецепторные тирозинкиназы (например, Akt1/GSK3beta, путь src и рецептор тромбоцитарного фактора роста, PDGFR) обычно активируются при хондросаркомах. В то время как доклинические исследования изначально предполагали активность ингибиторов тирозинкиназы при хондросаркомах, последующие клинические испытания иматиниба и дазатиниба не смогли продемонстрировать значимой клинической активности у пациентов с распространенной или метастатической хондросаркомой, однако данные препараты остались одной из опций лечения пациентов с ХС.
● Рецепторы эстрогена. Хотя рецепторы эстрогена и активность ароматазы были идентифицированы при хондросаркомах, ингибиторы ароматазы не улучшали выживаемость без прогрессирования по сравнению с нелечеными пациентами в одном исследовании.
●Ингибиторы PARP. Клеточные линии хондросаркомы обладают различной чувствительностью к ингибированию поли(АДФ-рибозо)полимеразы (PARP) талазопарибом независимо от наличия или отсутствия мутации IDH. Более того, ингибирование PARP повышает чувствительность клеточных линий хондросаркомы к химиотерапии (т.е. темозоломиду) и/или лучевой терапии. В одном исследовании II фазы у трех из пяти пациентов с IDH-мутантной хондросаркомой наблюдался клинический эффект от олапариба, включая одного пациента с частичным ответом и двух пациентов со стабильным заболеванием, продолжающимся более 7 месяцев.
● Ингибиторы HDAC. Клетки хондросаркомы демонстрируют высокую чувствительность к ингибированию гистондеацетилазы (HDAC) как в 2D-, так и в 3D-моделях in vitro. Доклинические исследования также поддержали комбинацию ингибиторов ДНК-метилтрансферазы (DNMT) с ингибированием HDAC.
● Активно исследуются другие агенты, включая агонисты рецепторов смерти, ингибиторы ангиогенеза, антисмысловые молекулы фактора роста эндотелия сосудов, рекомбинантный человеческий Apo2L/TRAIL и моноклональные антитела, запускающие пути апоптоза.


Комментарии (0)